
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Изопроцессы. Законы Бойля — Мариотта, Гей-Люссака, Шарля.
|
|
Изопроцессы — равновесные процессы, в которых один из основных параметров сохраняется.
ИЗОБАРНЫЙ ПРОЦЕСС ( 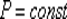 )
)
Для изобарного процесса в идеальном газе справедлив закон Гей-Люссака:
при постоянном давлении объем данной массы газа прямо пропорционален его термодинамической температуре:
 или
или 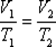 .
.
Молярная теплоемкость при изобарном процессе:
ИЗОХОРНЫЙ ПРОЦЕСС ( 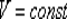 )
)
Изохорный процесс в идеальном газе описывается законом Шарля:
при постоянном объеме давление данной массы газа прямо пропорционально его термодинамической температуре:
 или
или 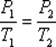 .
.
Работа газа при изохорном процессе равна нулю:  .
.
Все полученное тепло идет на изменение внутренней энергии в соответствии с первым началом термодинамики:
Молярная теплоемкость при изохорном процессе:
ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС ( 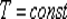 )
)
Изотермический процесс в идеальном газе подчиняется закону Бойля - Мариотта:
для данной массы газа при неизменной температуре произведение значений давления и объема есть величина постоянная:
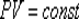 или
или 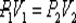 .
.
Работа газа при изотермическом расширении:.
Изменение внутренней энергии при изотермическом процессе равно нулю:
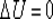 .
.
Все полученное тепло идет на совершение работы в соответствии с первым началом термодинамики:
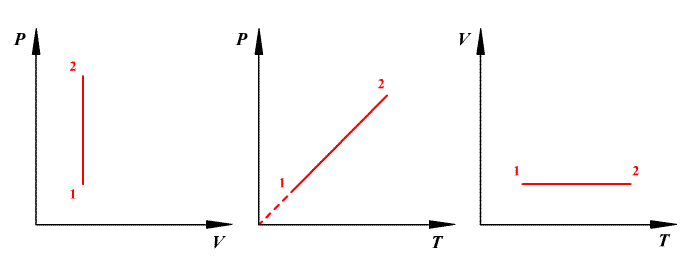
Законы Бойля — Мариотта, Гей-Люссака, Шарля
| Рис. 2.1 |
Для данной массы газа m при неизменной температуре Т произведение давления на объем есть величина постоянная:
Процесс, происходящий при постоянной температуре, называется изотермическим. График этого процесса в координатах p — V представлен на рис. 2.1.
| Рис. 2.2 |
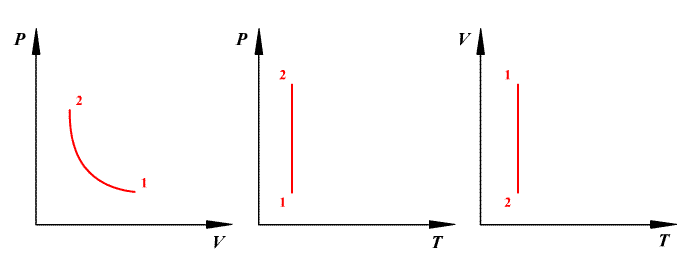
Закон, связывающий объем газа V и его температуру t, измеренную в градусах Цельсия, был установлен французским ученым Гей-Люссаком в 1802 г
Для данной массы m при постоянном давлении р объем газа линейно зависит от температуры: где V0 — объем газа при нуле градусов Цельсия, α — коэффициент объемного расширения, t — температура по шкале Цельсия.
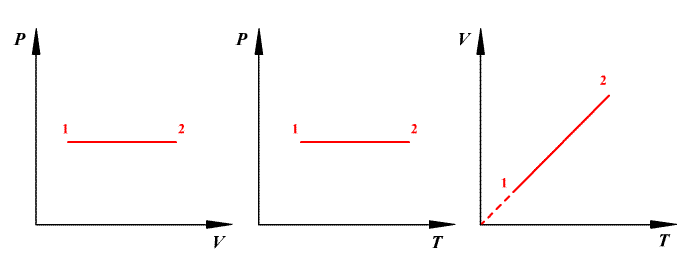
График этого процесса, называемого изобарическим, представлен на рис. 2.2. Коэффициент α для всех газов равен
Закон, связывающий давление газа р и его температуру t, установлен Шарлем.
Для данной массы m при постоянном объеме V давление газа линейно зависит от температуры:
где p0 — давление газа при нуле градусов Цельсия, β — коэффициент объемного расширения, t — температура по шкале Цельсия.
График этого процесса, называемого изохорическим, представлен на рис. 2.3. Коэффициент β для всех газов равен
В координатах Р–V изобарический и изохорический процессы представлены на рис. 2.4. 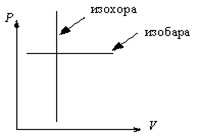
Опытные законы Бойля-Мариотта, Гей-Люссака и Шарля справедливы для широкого интервала давлений, объемов и температур. Однако когда давления превышают атмосферное в 300-400 раз, или температуры очень высоки, наблюдаются отклонения от этих законов. Тем не менее, во многих случаях эти законы удобны для практического применения.
Если бы существовал газ, для которого не было бы отклонений от этих законов, то такой газ был бы идеальным газом.