
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Робота 4.4. Потенціометричне титрування.
|
|
Мета роботи: визначити молярну концентрацію водного розчину електроліту потенціометричним методом.
Потенціометричне титрування використовують у разі визначення концентрації забарвлених або каламутних розчинів, де неможливе застосування кольорових індикаторів, а також для визначення вмісту окремих компонентів у сумішах кислот або основ, константи дисоціації яких відрізняються не менш, ніж на три порядки, і у сумішах електролітів, які внаслідок додавання титранту утворюють осади з суттєво різними добутками розчинності.
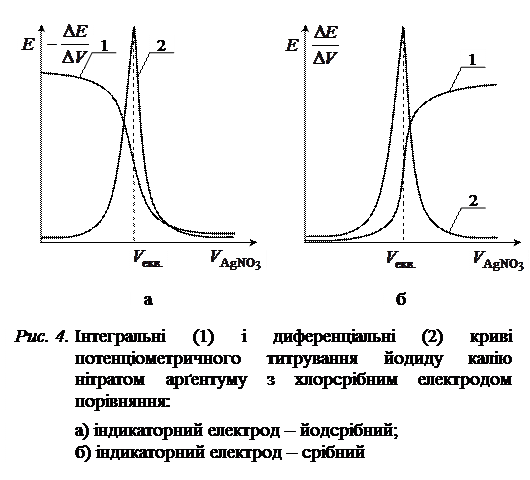
Для визначення концентрації досліджуваного розчину складають гальванічний елемент з двох електродів: електрода порівняння, потенціал якого залишається сталим у процесі титрування, та індикаторного електрода, потенціал якого залежить від концентрації (активності) іонів, що входять до складу утвореного внаслідок додавання титранту осаду або слабкого електроліту. Еквівалентний об’єм визначають за графічними залежностями 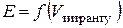 (інтегральна крива) або
(інтегральна крива) або 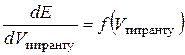 (диференціальна крива). Поблизу точки еквівалентності потенціал індикаторного електрода різко змінюється, що призводить у свою чергу до стрибка ЕРС ГЕ. Стрибки потенціалу індикаторного електрода і ЕРС ГЕ будуть тим більші, чим менші розчинність або ступінь дисоціації утвореної внаслідок додавання титранту сполуки.
(диференціальна крива). Поблизу точки еквівалентності потенціал індикаторного електрода різко змінюється, що призводить у свою чергу до стрибка ЕРС ГЕ. Стрибки потенціалу індикаторного електрода і ЕРС ГЕ будуть тим більші, чим менші розчинність або ступінь дисоціації утвореної внаслідок додавання титранту сполуки.
Якщо індикаторний електрод в ГЕ є катодом, то його потенціал і ЕРС ГЕ внаслідок додавання титранту згідно з (4.1) змінюються однаково (або зростають, або спадають). У випадку, коли індикаторний електрод є анодом у ланцюгу, його потенціал та ЕРС ГЕ змінюються протилежно (якщо 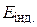 збільшується, то
збільшується, то 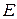 зменшується і навпаки).
зменшується і навпаки).
Наприклад, якщо розчин KI титрувати розчином AgNO3, то перебігає реакція:
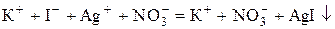 . (4.11)
. (4.11)
Електродом порівняння оберемо хлорсрібний (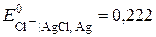 В за
В за 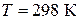 ). Індикаторними, приміром, можуть бути або йодсрібний (
). Індикаторними, приміром, можуть бути або йодсрібний (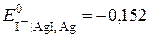 В за
В за 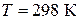 ), або срібний (
), або срібний (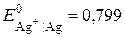 В за
В за 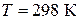 ) електроди, оскільки їх потенціали залежать відповідно від активності іонів
) електроди, оскільки їх потенціали залежать відповідно від активності іонів 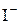 та Ag+, які входять до складу осаду AgI.
та Ag+, які входять до складу осаду AgI.
Якщо індикаторним є йодсрібний електрод, то схема ГЕ запишеться як
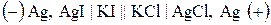 ,
,
потенціал індикаторного електрода 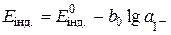 , а ЕРС ГЕ
, а ЕРС ГЕ 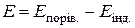 . Додавання до розчину КІ титранту AgNO3 зменшує концентрацію і, відповідно, активність
. Додавання до розчину КІ титранту AgNO3 зменшує концентрацію і, відповідно, активність 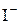 , внаслідок чого
, внаслідок чого 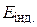 збільшується, а електрорушійна сила ланцюга
збільшується, а електрорушійна сила ланцюга 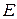 зменшується (рис. 4, а). Еквівалентний об’єм
зменшується (рис. 4, а). Еквівалентний об’єм 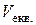 визначають за точкою максимального перегину інтегральної кривої.
визначають за точкою максимального перегину інтегральної кривої.
Якщо індикаторним є срібний електрод, то схема ГЕ запишеться як 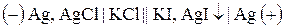 ,
,
потенціал індикаторного електрода 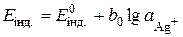 , а ЕРС ГЕ
, а ЕРС ГЕ 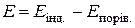 . Внаслідок додавання до розчину КІ титранту в системі утворюється малорозчинний осад AgI, що дисоціює з утворенням іонів арґентуму, концентрація яких майже не змінюється до еквівалентної точки. Після еквівалентної точки, коли титрант є у надлишку, концентрація і активність іонів Ag+ різко зростають, оскільки вони вже не зв’язуються йодид-іонами. Тому і
. Внаслідок додавання до розчину КІ титранту в системі утворюється малорозчинний осад AgI, що дисоціює з утворенням іонів арґентуму, концентрація яких майже не змінюється до еквівалентної точки. Після еквівалентної точки, коли титрант є у надлишку, концентрація і активність іонів Ag+ різко зростають, оскільки вони вже не зв’язуються йодид-іонами. Тому і 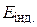 , і
, і 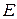 зростають (рис. 4, б).
зростають (рис. 4, б).
У випадку кислотно-основного титрування змінюється рН розчину, тому як індикаторний можна використовувати водневий, стибієвий, хінгідронний, скляний електроди, тому що їх потенціали залежать від кислотності середовища.
У деяких випадках стрибок ЕРС на інтегральній кривій титрування виявляється нечітким. Тоді для точного знаходження точки еквівалентності будують диференціальну криву (на практиці 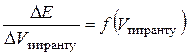 , див. рис. 4), екстремум якої відповідає максимальному перегину на інтегральній залежності і, відповідно, еквівалентному об’єму.
, див. рис. 4), екстремум якої відповідає максимальному перегину на інтегральній залежності і, відповідно, еквівалентному об’єму.
Для виконання роботи в склянку для титрування наливають досліджуваний розчин, занурюють в нього індикаторний електрод і з’єднують сольовим містком з електродом порівняння. Потім з бюретки послідовно додають певні об’єми титранту, перемішують і вимірюють ЕРС після кожної наступної порції. Об’єми досліджуваного розчину та порцій титранту задає викладач. Експеримент закінчують тоді, коли після стрибка електрорушійна сила ГЕ досягає практично незмінного значення. Дані експерименту записують у табл. 4.1 (див. звіт).
Будують, як показано на рис. 4, інтегральну та диференціальну криві. Для побудови другої кривої на осі абсцис відкладають об’єми 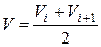 , а на осі ординат – значення
, а на осі ординат – значення 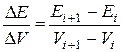 . На основі кривих титрування визначають еквівалентний об’єм і концентрацію досліджуваного розчину.
. На основі кривих титрування визначають еквівалентний об’єм і концентрацію досліджуваного розчину.
Звіт
1. Досліджуваний розчин: ___; об’єм досліджуваного розчину: 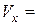 см3.
см3.
2. Титрант: ____; концентрація титранту: 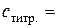 моль/дм3.
моль/дм3.
3. Рівняння реакції при титруванні:
4. Схема індикаторного електрода:
5. Вираз для потенціалу індикаторного електрода та аналіз його зміни при титруванні:
6. Схема гальванічного елементу:
7. Вираз для ЕРС ГЕ та аналіз її зміни при титруванні:
8. Результати титрування:
Таблиця 4.1. Результати потенціометричного титрування
| № | 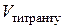 , см3 , см3
| 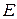 , В , В
| 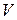 , см3 , см3
| 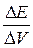 , В/см3 , В/см3
| |
| – | – | ||||
| … |
9. Побудова графіків 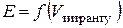 і
і 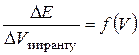 .
.
10. Визначення еквівалентного об’єму за перегином на графіку 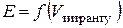 та за екстремумом на графіку
та за екстремумом на графіку 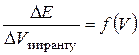 :
: 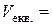 см3.
см3.
11. Обчислення концентрації досліджуваного розчину: 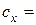 моль/дм3.
моль/дм3.
12. Висновок.
ЛІТЕРАТУРА: [3, с. 301 – 303; 5, с. 315 – 323; 7, с. 142; 8, с. 54 – 56].
5. ПОТЕНЦІОМЕТРИЧНЕ ВИЗНАЧЕННЯ рН
Водневим показником 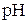 називається від’ємний десятковий логарифм активності іонів водню:
називається від’ємний десятковий логарифм активності іонів водню:
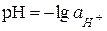 . (5.1)
. (5.1)
У загальному випадку для 1–1-валентних електролітів
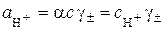 ,
,
де 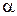 – ступінь дисоціації електроліту у розчині;
– ступінь дисоціації електроліту у розчині; 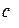 – молярна концентрація розчину;
– молярна концентрація розчину; 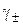 – середній іонний коефіцієнт активності електроліту в розчині (довідникова величина).
– середній іонний коефіцієнт активності електроліту в розчині (довідникова величина).
Для сильних 1–1-валентних електролітів 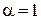 . Тоді
. Тоді
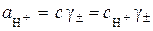
і
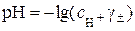 . (5.2)
. (5.2)
Якщо концентрація розчину сильного електроліту дуже мала 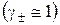 , то його
, то його 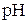 наближено можна розраховувати за формулою
наближено можна розраховувати за формулою
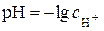 .
.
Для не дуже розведених розчинів слабких 1–1-валентних електролітів 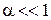 ,
, 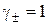 і тоді
і тоді
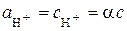 . (5.3)
. (5.3)
Згідно із законом розведення Оствальда ступінь дисоціації слабкого
1–1-валентного електроліту пов’язаний з концентрацією розчину таким чином:
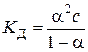 , (5.4)
, (5.4)
де 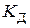 – константа дисоціації слабкого 1–1-валентного електроліту (довідникова величина), яка залежить від природи електроліту та розчинника, а також від температури. Для наближеного розрахунку (
– константа дисоціації слабкого 1–1-валентного електроліту (довідникова величина), яка залежить від природи електроліту та розчинника, а також від температури. Для наближеного розрахунку (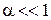 ) рівняння (5.4) можна записати у вигляді:
) рівняння (5.4) можна записати у вигляді:
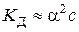 ,
,
звідки
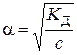 .
. 
Тоді, виходячи з рівняння (5.3), маємо
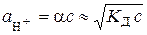 ,
,
а за (5.1):
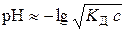 . (5.5)
. (5.5)
Для точного розрахунку 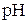 розчину слабкого електроліту ступінь його дисоціації визначають, розв’язуючи квадратне рівняння (5.4).
розчину слабкого електроліту ступінь його дисоціації визначають, розв’язуючи квадратне рівняння (5.4).
Вода є дуже слабким електролітом, який дисоціює за рівнянням:
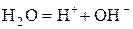 .
.
Константа рівноваги цього процесу записується як:
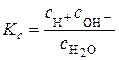 .
.
Оскільки для води 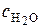 за сталої температури незмінна, то
за сталої температури незмінна, то 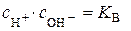 , (5.6)
, (5.6)
де 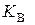 – константа, яку називають іонним добутком води і яка залежить від температури. За стандартної температури
– константа, яку називають іонним добутком води і яка залежить від температури. За стандартної температури 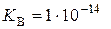 (моль/дм3)2, а
(моль/дм3)2, а 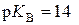 , оскільки
, оскільки 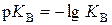 . Отже, у водних розчинах концентрації іонів
. Отже, у водних розчинах концентрації іонів 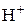 та
та 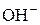 не можуть бути довільними, оскільки вони пов’язані рівнянням (5.6). На підставі цієї формули можна записати
не можуть бути довільними, оскільки вони пов’язані рівнянням (5.6). На підставі цієї формули можна записати
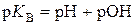 , (5.7)
, (5.7)
де 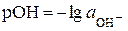 .
.
Нейтральним вважається розчин, в якому 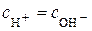 (
(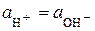 ). За
). За 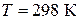 нейтральному середовищу відповідає
нейтральному середовищу відповідає 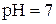 , кислому –
, кислому – 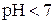 , лужному –
, лужному –  .
.
Потенціометричний метод визначення 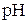 полягає у вимірюванні потенціалу зануреного у досліджуваний розчин індикаторного електрода, який є оборотним відносно іонів
полягає у вимірюванні потенціалу зануреного у досліджуваний розчин індикаторного електрода, який є оборотним відносно іонів 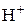 та
та 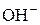 , тобто його потенціал залежить від концентрації цих іонів. Індикаторними електродами можуть слугувати: водневий електрод (
, тобто його потенціал залежить від концентрації цих іонів. Індикаторними електродами можуть слугувати: водневий електрод (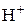 або
або 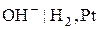 ), стибієвий (
), стибієвий (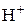 або
або 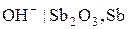 ), хінгідронний (
), хінгідронний (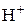 або
або 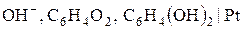 ) та скляний (
) та скляний (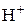 або
або  ).
).
За 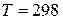 К потенціал водневого електрода пов’язаний з
К потенціал водневого електрода пов’язаний з 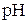 розчину рівнянням:
розчину рівнянням: 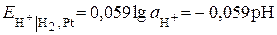 .
.
Для потенціалів інших індикаторних електродів за стандартної температури: 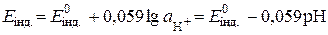 .
.
В приладах  – метрах як індикаторний використовується скляний електрод. Він являє собою тонкостінну кулеподібну мембрану зі спеціального скла з підвищеним вмістом лужних складових, яка припаяна до звичайної скляної трубки. Усередині цієї кульки розміщено хлорсрібний електрод в 0, 1 – молярному водному розчині НСl. При зануренні скляного електрода в досліджуваний водний розчин на внутрішній і зовнішній поверхнях мембрани перебігають процеси обміну між іонами
– метрах як індикаторний використовується скляний електрод. Він являє собою тонкостінну кулеподібну мембрану зі спеціального скла з підвищеним вмістом лужних складових, яка припаяна до звичайної скляної трубки. Усередині цієї кульки розміщено хлорсрібний електрод в 0, 1 – молярному водному розчині НСl. При зануренні скляного електрода в досліджуваний водний розчин на внутрішній і зовнішній поверхнях мембрани перебігають процеси обміну між іонами 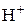 , що перебувають у розчинах, та катіонами лужних металів, які містяться у склі. Внаслідок цього виникають два стрибки потенціалу, які залежать від
, що перебувають у розчинах, та катіонами лужних металів, які містяться у склі. Внаслідок цього виникають два стрибки потенціалу, які залежать від 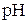 розчинів усередині та ззовні мембрани. Оскільки
розчинів усередині та ззовні мембрани. Оскільки 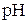 розчину в скляній кульці є сталим, то потенціал цього індикаторного електрода залежить тільки від
розчину в скляній кульці є сталим, то потенціал цього індикаторного електрода залежить тільки від 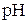 зовнішнього досліджуваного розчину.
зовнішнього досліджуваного розчину.
Потенціал скляного електрода за 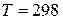 К виражається рівнянням:
К виражається рівнянням: 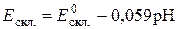 ,
,
де 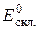 – стандартний для певного скляного електрода потенціал, який визначають його калібруванням за допомогою буферних розчинів з відомими значеннями
– стандартний для певного скляного електрода потенціал, який визначають його калібруванням за допомогою буферних розчинів з відомими значеннями 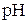 .
.
Електродом порівняння в  – метрах зазвичай є каломельний.
– метрах зазвичай є каломельний.
Розчини з певною концентрацією іонів водню, 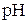 яких мало змінюється внаслідок розведення або додавання незначних кількостей сильних кислот або лугів, називають буферними. Буферні розчини готують із суміші слабкої кислоти та солі, що утворена взаємодією цієї кислоти з лугом, або слабкої основи та солі, яка є продуктом взаємодії між цією основою та сильною кислотою. Концентрацію
яких мало змінюється внаслідок розведення або додавання незначних кількостей сильних кислот або лугів, називають буферними. Буферні розчини готують із суміші слабкої кислоти та солі, що утворена взаємодією цієї кислоти з лугом, або слабкої основи та солі, яка є продуктом взаємодії між цією основою та сильною кислотою. Концентрацію 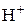 в кислому буферному розчині розраховують за формулою:
в кислому буферному розчині розраховують за формулою:
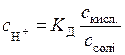 , (5.8)
, (5.8)
де 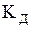 – константа дисоціації слабкої кислоти;
– константа дисоціації слабкої кислоти; 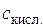 ,
, 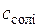 – концентрації кислоти і солі у буферному розчині. Для визначення концентрації
– концентрації кислоти і солі у буферному розчині. Для визначення концентрації 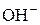 в основному буферному розчині використовують формулу, подібну до (5.8).
в основному буферному розчині використовують формулу, подібну до (5.8).