
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Робота 4.3. Визначення добутку розчинності галогеніду арґентуму у водному розчині.
|
|
Мета роботи: визначити розчинність і добуток розчинності галогеніду арґентуму у водному розчині потенціометричним методом.
У насиченому водному розчині малорозчинного галогеніду арґентуму AgHal за певної температури встановлюється рівновага
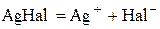 . (4.7)
. (4.7)
Добуток розчинності (ДР) малорозчинного електроліту – це добуток активностей іонів у насиченому розчині, на які дисоціює сполука, з показниками степенів, що дорівнюють стехіометричним коефіцієнтам в рівнянні (4.7). ДР за 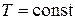 є сталою величиною.
є сталою величиною.
Для галогеніду арґентуму добуток розчинності виражається формулою
 , (4.8)
, (4.8)
а розчинність 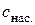 такого бінарного електроліту дорівнює:
такого бінарного електроліту дорівнює:
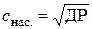 . (4.9)
. (4.9)
Для експериментального визначення ДР AgHal складають концентраційний гальванічний елемент. Для цього в одну пробірку за вказівкою викладача наливають 0, 1-моляльний розчин галогеніду калію, до якого піпеткою додають декілька крапель AgNO3 до появи каламуті (активність іонів арґентуму в утвореному розчині складає 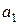 і дорівнює
і дорівнює 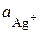 в рівнянні (4.8)), та занурюють срібний електрод. В іншу пробірку наливають 0, 1-моляльний розчин AgNO3 з активністю іонів арґентуму
в рівнянні (4.8)), та занурюють срібний електрод. В іншу пробірку наливають 0, 1-моляльний розчин AgNO3 з активністю іонів арґентуму 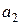 і також занурюють в нього срібний електрод. Зрозуміло, що
і також занурюють в нього срібний електрод. Зрозуміло, що 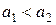 , оскільки внаслідок утворення в першій пробірці малорозчинного AgHal концентрація Ag+ в ній дуже мала. Розчини з’єднують сифоном і вимірюють ЕРС ГЕ, схема якого має вигляд:
, оскільки внаслідок утворення в першій пробірці малорозчинного AgHal концентрація Ag+ в ній дуже мала. Розчини з’єднують сифоном і вимірюють ЕРС ГЕ, схема якого має вигляд:
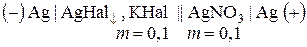 .
.
Електрорушійна сила цього ланцюга за стандартної температури виражається рівнянням:
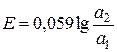 . (4.10)
. (4.10)
З рівняння (4.10) на основі вимірювання ЕРС визначають 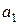 , обчисливши активність іонів Ag+
, обчисливши активність іонів Ag+ 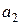 в 0, 1-моляльному розчині AgNO3 за формулою (4.3). Так само розраховують активність галогенід-іонів
в 0, 1-моляльному розчині AgNO3 за формулою (4.3). Так само розраховують активність галогенід-іонів 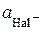 у 0, 1-моляльному розчині KHal.
у 0, 1-моляльному розчині KHal.
Для визначення добутку розчинності одержані значення 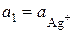 і
і 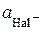 підставляють у рівняння (4.8). За величиною ДР обчислюють на основі (4.9) розчинність відповідного галогеніду арґентуму у воді. Одержані результати порівнюють з даними довідника.
підставляють у рівняння (4.8). За величиною ДР обчислюють на основі (4.9) розчинність відповідного галогеніду арґентуму у воді. Одержані результати порівнюють з даними довідника.
Звіт
1. Досліджуваний галогенід арґентуму:
2. Схема гальванічного елементу:
3. Експериментальне значення ЕРС елементу: 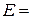 В.
В.
4. Середній іонний коефіцієнт активності 0, 1-моляльного розчину AgNO3: 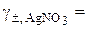
5. Обчислення 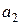 за рівнянням (4.3):
за рівнянням (4.3): 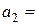 моль/кг.
моль/кг.
6. Розрахунок 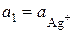 за рівнянням (4.10):
за рівнянням (4.10): 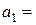 моль/кг.
моль/кг.
7. Середній іонний коефіцієнт активності 0, 1-моляльного розчину KHal: 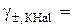
8. Розрахунок 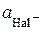 за рівнянням (4.3):
за рівнянням (4.3): 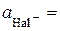 моль/кг.
моль/кг.
9. Обчислення експериментального значення ДР AgHal за (4.8): 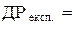 моль2/кг2.
моль2/кг2.
10. Довідникове значення ДР AgHal: 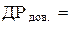 моль2/дм6.
моль2/дм6.
11. Розрахунок розчинності AgHal за (4.9): 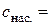 моль/кг.
моль/кг.
12. Висновок.
ЛІТЕРАТУРА: [1, с. 466 – 476, 479 – 492; 2, с. 248 – 270; 3, с. 263 – 265, 276 – 297, 301; 4, с. 288 – 304; 5, с. 283 – 298; 6, с. 128 – 130, 135 – 149, 163; 7, с. 143 – 147; 8, с. 53 – 55].