
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Робота 3.3. Визначення константи дисоціації слабкого електроліту.
|
|
Мета роботи: визначити константи дисоціації слабкого електроліту в розчинах різної концентрації та підтвердити закон розведення Оствальда.
В електролітичну комірку наливають піпеткою 10 см3 розчину слабкого 1–1-валентного електроліту (за вказівкою викладача), витримують в термостаті 8 – 10 хв. і вимірюють його опір (для виконання роботи може бути використано розчин слабкого електроліту з попереднього досліду 3.2). Потім додають до нього 10 см3 дистильованої води (концентрація зменшується удвічі), ретельно перемішують, термостатують і знову вимірюють опір.
Для подальшого розведення розчину удвічі кожного разу піпеткою відбирають із комірки 10 см3 рідини, додають 10 см3 дистильованої води, перемішують, термостатують і вимірюють опір. Розраховують для розчину кожної концентрації розведення, питому і молярну електропровідності, ступінь і константу дисоціації електроліту. Результати вимірювань і розрахунків записують у табл. 3.3.
Звіт
1. Температура досліду: 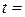 о С.
о С.
2. Електроліт: _____;
гранична молярна електропровідність: 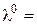 См× см2/моль.
См× см2/моль.
3. Таблиця 3.3. Експериментальні дані та розраховані величини
| № | 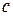 ,
моль/дм3 ,
моль/дм3
| 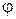 ,
дм3/моль ,
дм3/моль
| 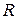 ,
Ом ,
Ом
| 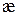 ,
См/см ,
См/см
| 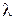 ,
См× см2/моль ,
См× см2/моль
| 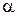
| 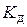 ,
моль/дм3 ,
моль/дм3
|
| × × × |
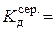
4. Довідникове значення константи дисоціації електроліту за температури 25 о С: 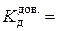 моль/дм3.
моль/дм3.
5. Побудова графіків: 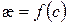 ,
, 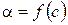 ,
, 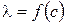 ,
, 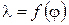 .
.
6. Висновок.
ЛІТЕРАТУРА: [1, с. 429 – 437, 458 – 463; 2, с. 226 – 233, 235 – 243; 3, с. 222 – 225, 245 – 253, 257 – 258; 4, с. 268 – 281; 5, с. 249 – 255, 262 – 263; 6, с. 182 – 194; 7, с. 123 – 124, 136 – 137; 8, с. 51 – 52].