
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Робота 3.2. Дослідження електропровідності розчинів сильних та слабких електролітів.
|
|
Мета роботи: визначити питому, молярну електропровідності розчинів електролітів, ступінь дисоціації слабкого електроліту та коефіцієнт електропровідності сильного електроліту.
В електролітичну комірку наливають розчин сильного електроліту (за вказівкою викладача) і після термостатування за необхідної температури вимірюють його опір. Після цього посудину для вимірювання електропровідності промивають дистильованою водою і наливають в неї піпеткою 10 см3 розчину слабкого 1–1-валентного електроліту (за вказівкою викладача), термостатують і вимірюють опір.
Питому електропровідність розчинів обчислюють за формулою:
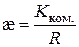 . (3.13)
. (3.13)
Молярну електропровідність електроліту 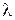 розраховують за формулою (3.4), граничну молярну електропровідність
розраховують за формулою (3.4), граничну молярну електропровідність 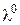 визначають за довідниковими даними на основі рівняння (3.7). Для сильних електролітів обчислюють коефіцієнт електропровідності (за 3.9), для слабких – ступінь дисоціації (за 3.8). Виміряні та розраховані величини зводять у табл. 3.2.
визначають за довідниковими даними на основі рівняння (3.7). Для сильних електролітів обчислюють коефіцієнт електропровідності (за 3.9), для слабких – ступінь дисоціації (за 3.8). Виміряні та розраховані величини зводять у табл. 3.2.
Звіт
1. Температура досліду: 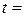 о С.
о С.
2. Таблиця 3.2. Результати експерименту та обчислень
| № | Електроліт | с, моль/дм3 | R, Ом | 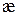 ,
См/см ,
См/см
| 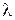 ,
См× см2/моль ,
См× см2/моль
| 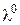 , См× см2/моль , См× см2/моль
| 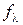 або або 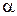
|
Обчислення для сильного електроліту:
Обчислення для слабкого електроліту:
3. Висновок.