
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лекция 6. Спирты.
|
|
Органическая химия.
Тема: «Кислородсодержащие органические соединения»
Лекция 6. Спирты.
План.
1. Классификация спиртов. Гомологический ряд предельных одноатомных спиртов.
2. Номенклатура и изомерия предельных одноатомных спиртов.
3. Физические свойства. Физиологическое действие.
4. Состав и строение молекулы этанола.
5. Химические свойства.
6. Получение и применение.
7. Многоатомные спирты. Особенности строения, номенклатура, изомерия.
8. Строение, физические и химические свойства глицерина.
9. Получение, применение глицерина и его роль в живых организмах.
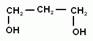
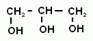
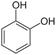
1.Соединения алифатического ряда, содержащие одну или несколько гидроксогрупп, называются спиртами (если нет в молекуле более старших функциональных групп). Если молекула содержит одну гидроксогруппу, то спирт называется одноатомным, если две – двухатомным, три – трехатомным и т.д. Для одноатомных спиртов общая формула: R-OH, где R- углеводородный алифатический радикал. Он может быть предельным, непредельным и даже содержать ароматическое кольцо. Тогда спирты так и называют: предельные, непредельные или ароматические. Если группа –ОН посредственно соединена с бензольным кольцом, то производные будут называться фенолами. Кроме того, различают первичные, вторичные и третичные спирты, в зависимости от того с каким атомом углерода соединена группа –ОН.


 1) 2) 3) 4)
1) 2) 3) 4)



 5) 6) 7)
5) 6) 7)
Мы начнем изучение спиртов с группы предельных одноатомных спиртов. Т.е. радикал является остатком предельного углеводорода, и в молекуле спирта только одна гидроксогруппа.

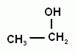
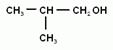
 2. Номенклатура и изомерия предельных одноатомных спиртов. Наличие гидроксогруппы (если она главная) обозначается в названии вещества суффиксом –ол. Положение гидроксогруппы в молекуле спирта указывается цифрой после суффикса. Нумерацию цепи начинают с того конца, ближе к которому находится гидроксильная группа. Для спиртов возможна структурная изомерия и изомерия положения функциональной группы. Возможна и межклассовая изомерия с простыми эфирами. Число структурных изомеров быстро возрастает с увеличением числа углеродов. Для С4 сущестует четыре изомерных спирта, для С5 их восемь, а для С10 уже 567.
2. Номенклатура и изомерия предельных одноатомных спиртов. Наличие гидроксогруппы (если она главная) обозначается в названии вещества суффиксом –ол. Положение гидроксогруппы в молекуле спирта указывается цифрой после суффикса. Нумерацию цепи начинают с того конца, ближе к которому находится гидроксильная группа. Для спиртов возможна структурная изомерия и изомерия положения функциональной группы. Возможна и межклассовая изомерия с простыми эфирами. Число структурных изомеров быстро возрастает с увеличением числа углеродов. Для С4 сущестует четыре изомерных спирта, для С5 их восемь, а для С10 уже 567.
 1) 2)
1) 2)  3)
3)  4) 5)
4) 5)
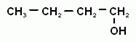

 6) 7) 8) 9)
6) 7) 8) 9)
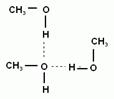 3. Физические свойства. Среди спиртов нет газов. Вследствие образования водородных связей между гидроксогруппами спиртов, они имеют аномально высокие температуры кипения. Например, этиловый спирт - это жидкость с характерным запахом и жгучим вкусом, перегоняется при 78, 15о (такой спирт содержит 95, 5% спирта (по массе) и называется ректификатом). Безводный этиловый спирт можно получить, связывая воду химически. Обычно концентрацию спирта выражают не в массовых долях (процентах), а в объемных. Объемные проценты называют градусами. При смешивании спирта и воды общий объем уменьшается, и эти величины не совпадают. Например, спирт-ректификат имеет крепость 96о. Т.о. при н.у. низшие спирты являются жидкостями, бесцветными и прозрачными, с характерным запахом. Спирты, содержащие более 15 атомов углерода являются твердыми веществами и запаха не имеют.
3. Физические свойства. Среди спиртов нет газов. Вследствие образования водородных связей между гидроксогруппами спиртов, они имеют аномально высокие температуры кипения. Например, этиловый спирт - это жидкость с характерным запахом и жгучим вкусом, перегоняется при 78, 15о (такой спирт содержит 95, 5% спирта (по массе) и называется ректификатом). Безводный этиловый спирт можно получить, связывая воду химически. Обычно концентрацию спирта выражают не в массовых долях (процентах), а в объемных. Объемные проценты называют градусами. При смешивании спирта и воды общий объем уменьшается, и эти величины не совпадают. Например, спирт-ректификат имеет крепость 96о. Т.о. при н.у. низшие спирты являются жидкостями, бесцветными и прозрачными, с характерным запахом. Спирты, содержащие более 15 атомов углерода являются твердыми веществами и запаха не имеют.
Спирты могут растворяться в воде. (Почему?) Первые три члена гомологического ряда (метанол, этанол, пропанол) неограниченно растворимы в воде. С увеличением углеводородного радикала растворимость спиртов падает. Высшие спирты не растворимы в воде. Сами спирты являются хорошими растворителями для органических и для неорганических веществ.
Физиологическое действие спиртов. В растворах спиртов денатурирует белок. Метанол ( метиловый или древесный спирт) СН3ОН – сильный яд, в пищеварительном тракте образует формальдегид и муравьиную кислоту. Попадание в организм даже небольших (5-10 г) количеств метанола вызывает слепоту, а дозы от 30 г приводят к смертельному исходу. Этанол (виноградный или медицинский спирт) С2H5OH обладает наркотическим (затормаживаются реакции, нарушается координация, появляется эффект привыкания) и обезболивающим действием. При систематическом потреблении вызывает глубокие нарушения работы ЖКТ, печени, сердечно- сосудистой системы, разрушение нервной системы. В больших количествах и одноразовый прием - смертельно опасен (около 6—8 г/кг массы тела).
4. Строение молекулы этанола. С2H5/→ O ← H или С2H5→ O ← /H
С появлением гидроксогруппы в молекуле спирта появляются две сильно полярные связи. Причем электронная плотность в обоих связях смещена к более электроотрицательному кислороду и на нем находится избыток электронной плотности. А на атоме водорода образуется частичный положительный заряд. Полярные связи рвутся легче, чем неполярные. Здесь у нас есть два варианта. Или образуется нуклеофильная группа гидроксогруппа ОН- и электрофил С2H5. Или образуется нуклеофильная группа OС2H5 и электрофил Н+.
5. Химические свойства.
1). Для спиртов возможна реакция замещения водорода на натрий (SЕ):
С2H5OH + Na  С2H5ONa + H2
С2H5ONa + H2
В этой реакции проявляются кислотные свойства спиртов, образующиеся вещества называют алкоголятами (этилат натрия). Но спирты нельзя назвать кислотами, потому что растворы спиртов имеют нейтральную реакцию, и со щелочами они не взаимодействуют.
2). Но для спиртов более характерны реакции замещения гидроксогруппы (SN), например, с галогеноводородами или молекулой другого спирта (образование простых эфиров).
С2H5 OH + H Cl → С2H5Cl + H-OH
С2H5 OH + С2H5O H ↔ С2H5-O-С2H5+ H2O реакция идет при нагревании до 140 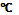
3). Кроме того для спиртов возможны реакции отщепления (элиминирования Е).
СН3-СН2ОН → СН2=СН2 + H2O реакция идет при нагревании выше 140 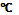 в присутствии конц. Серной кислоты, как водоотнимающего средства. Внутримолекулярная дегидратация у гомологов этанола проходит по правилу Зайцева: водород отщепляется от менее гидрогенизированного атома углерода.
в присутствии конц. Серной кислоты, как водоотнимающего средства. Внутримолекулярная дегидратация у гомологов этанола проходит по правилу Зайцева: водород отщепляется от менее гидрогенизированного атома углерода.
4). Как и все органические вещества спирты легко окисляются при повышенной температуре в присутствии воздуха.
С2H5OH + О2  СO2 + H2O, причем ∆ Н=1374 кДж. Спирт этанол горит бесцветным голубоватым пламенем.
СO2 + H2O, причем ∆ Н=1374 кДж. Спирт этанол горит бесцветным голубоватым пламенем.
При действии более мягких окислителей из спирта образуются альдегиды (из первичного) или кетоны (из вторичного). Например:

СH3-CH2-OH + CuO → + Cu + H2O
Третичный спирт окисляется только при жестких условиях с разрывом связи С-С и образованием нескольких кислот.