
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теплота, підведена ззовні до робочого тіла, витрачається на здійснення роботи зміни об’єму РТ і на зміну внутрішньої енергії.
|
|
За одиницю роботи і теплоти прийнятий 1 Дж. Тоді одиницею потужності буде 1Дж/с = 1Вт. У техніці широко застосовується позасистемна одиниця вимірювання теплової енергії – калорія (кал). 1 кал = 4, 187Дж, або 1ккал=4, 187кДж. 1 кал відповідає 427 кГ·м (механічний еквівалент теплоти). Робота 1 кВт за годину (1 кВт·год) відповідає 860 ккал (тепловий еквівалент кіловат-години). Тоді годинна кількість теплоти 1 ккал/год буде еквівалентною 1, 16 Дж/сек (Вт), а 1Вт відповідає 0, 857 ккал/год, 1 MВт = 0, 857 Гкал/год.
Δ U = U2 – U1 = q1-2 – l1-2, кДж/кг.
Це свідчить про те, що внутрішня енергія РТ може зменшуватись як при відведенні, так і при підведенні теплоти. Так, якщо у процесі відбувається розширення робочого тіла, то здійснюється робота l1-2 > 0 і теплота відводиться від РТ. Якщо при цьому кількість теплоти q1-2, яка підводиться до робочого тіла буде меншою за роботу (q1-2 < l1-2), то внутрішня енергія зменшується, (U2 – U1 < 0), витрачаючись частково на виконання роботи.
Для РТ, що рухається в каналі довільної форми (для потоку), в перетворенні енергії бере участь не тільки внутрішня енергія, а й потенціальна енергія тиску, прикладеного до потоку, і потенціальна енергія гравітації. Останньою, як правило, нехтують унаслідок її незначних величин. Тоді енергія тіла здатна перетворюватися в приріст кінетичної енергії й у зовнішню роботу, складається із внутрішньої енергії U та потенціальної енергії тиску pυ
і = U + pυ.
Ця величина називається ентальпією і в потоці (відкритій системі) характеризує повну енергію робочого тіла.
Аналітичний вираз першого закону термодинаміки в диференціальній формі через ентальпію
dU = di – d(pυ) = di – pdυ – υ dp,
dq = dU + dl = di – pdυ – υ dp + pdυ,
dq = di – υ dp.
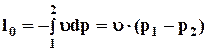 Добуток υ dp, на відміну від роботи розширення pdυ, називається розрахунковою роботою і позначається l0
Добуток υ dp, на відміну від роботи розширення pdυ, називається розрахунковою роботою і позначається l0
v, кДж/кг.
Це робота зовнішніх сил, що діють на РТ. У закритих системах розрахункова робота витрачається для збереження незмінним об’єму робочого тіла υ, обмеженого непружними стінками системи.
Розрахункова робота l0 дорівнює зміні потенціальної енергії тиску системи.
У відкритих системах (для потоку) розрахункова робота складається із роботи розширення pdυ і роботи потенціальної енергії тиску d(pυ). При зменшенні тиску й потенціальної енергії потоку робота, в яку вона перетворюється, має додатне значення. При стискуванні робочого тіла у потоці необхідно підвести зовнішню роботу, і вона матиме від’ємне значення.
Залежністю користуються, наприклад, при встановленні витрат роботи на стискування пружної рідини (води, нафти, конденсату тощо), при адіабатних умовах (dS = 0, dq = 0). При стискуванні рідин величина питомого об’єму υ практично не змінюється, υ = const.
Для потоку робочого тіла перший закон термодинаміки має загальний вигляд
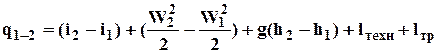 .
.
Таким чином, теплова енергія, що підведена до рухомого робочого тіла у каналі, витрачається на наступне:
– зміну кінетичної енергії потоку 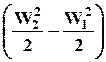 ;
;
–  зміну ентальпії робочого тіла
зміну ентальпії робочого тіла 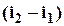 ;
;
– роботу для підйому РТ із висоти h1 до h2,;
(при h1= h2 ця робота відсутня)
– виконання технічної роботи або одержання технічної роботи (за наявності у потоці обертових пристроїв). За відсутності таких пристроїв цієї роботи не буде, lтехн = 0;
– роботу на подолання сил тертя на стінках каналу. За відсутності сил тертя або їх знехтуванні у зворотних процесах, lтр = 0.
Другий закон термодинаміки встановлює напрямок, у якому проходять процеси, й умови перетворення теплоти в роботу, а також максимально можливу величину роботи.
Неперервне перетворення теплоти в роботу можливе тільки в круговому процесі (циклі), за яким працюють теплові двигуни. Для цього цикл повинен складатись з елементарних зворотних процесів, у частині яких теплота підводиться до робочого тіла (dq > 0, dS > 0) і здійснюється робота із розширення (dυ > 0, dl> 0), а в інших – теплота відводиться (dq < 0, dS < 0), витрачається зовнішня робота, а РТ стискується (dυ < 0, dl< 0). У результаті робоче тіло повертається у вихідний стан.
Самовільний перехід теплоти від тіла з меншою температурою до тіла з більшою температурою не можливий без компенсації (у вигляді зовнішньої роботи) – таке формулювання II закону термодинаміки відоме під назвою постулату Клаузиса.
Існує ще декілька формулювань другого закону термодинаміки:
– для здійснення циклу теплового двигуна необхідно мати не менше від двох джерел теплоти різної температури (гаряче і холодне);
– не можливе існування вічного двигуна другого роду, в якому теплота тільки підводилась би, неминучим є відведення теплоти до холодного джерела теплоти.
Усі формулювання другого закону термодинаміки справедливі для зворотних ідеальних процесів.
Термічний ККД – відношення корисно використаної теплоти q0 (одержаної роботи l0) до всієї теплоти, затраченої для здійснення циклу q1; визначає термодинамічну ефективність циклу
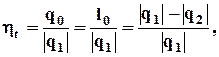 част. од.,
част. од.,
де q1 – теплота, підведена в циклі до робочого тіла від гарячого джерела теплоти, кДж/кг;
q2 – теплота, відведена від РТ до холодного джерела теплоти, кДж/кг.
Найбільш повне перетворення теплоти в роботу відбувається в ідеальному циклі теплового двигуна – циклі Карно. Він складається із двох ізотерм (Т1 = сonst 1–2, Т2 = сonst 3–4) і двох адіабат (dq=0 2–3 і 4–1). Зображення таких процесів у складі циклу Карно показано в координатах Р– υ і Т– S на рис.2.
Площа під лінією процесу в Р– υ діаграмі характеризує роботу процесу, а в координатах Т– S площа під лінією процесу означає кількість теплоти, що підводиться (при dS > 0) або відводиться (dS < 0) у процесі. Для ідеального, ізольованого зворотного циклу сума величин зміни ентропії для всіх процесів циклу 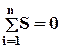 . Для циклів реальних теплових двигунів
. Для циклів реальних теплових двигунів  > 0.
> 0.
Це пояснюється незворотністю довільних природних процесів переходу теплоти від більшої температури до меншої при нагріванні РТ і підведенні до нього теплоти, а також збільшенням ентропії при незворотному адіабатному стискуванні ідеального газу. Нерівність називають законом збільшення ентропії.
В ідеальних недовільних (примусових) процесах, пов’язаних із передачею енергії від тіл з меншою температурою до тіл з більшою температурою, перетворення енергії відбувається всупереч її природному характеру. В таких процесах ентропія зменшується.
Отже, величина зміни ентропії  у циклі характеризує властивість відновлювальної робото здатності робочого тіла і термодинамічної системи.
у циклі характеризує властивість відновлювальної робото здатності робочого тіла і термодинамічної системи.
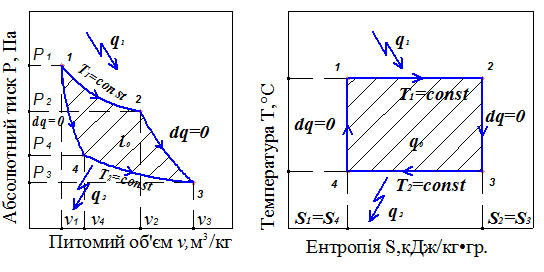
Рис.2. Цикл Карно в Р– υ і Т– S - координатах
У довільних природних процесах різниця потенціалів зменшується, система наближається до стану рівноваги, втрачається можливість системи здійснювати роботу, теплота переходить до меншого потенціалу і втрачається у навколишньому середовищі. Система таким чином деградує.
Відповідно до першого закону термодинаміки
q1-2 = Δ U1-2 + l1-2; q2-3= 0 = Δ U2-3 + l2-3, кДж/кг;
q3-4 = Δ U3-4 + l3-4; q4-1= 0 = Δ U4-1 + l4-1, кДж/кг.
Теплота, що буде використана для здійснення роботи
q0 = q1-2–|q3-4| = l0, кДж/кг.
Згідно із Т– S - діаграмою:
q1-2 = Т1(S2 – S1); q3-4 = Т2(S3 – S4); S2 – S1 = S3 – S4, кДж/кг.
Термічний ККД визначають за формулою
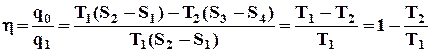 . (42)
. (42)