
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Рівняння стану ідеального газу
|
|
 На основі експериментальних досліджень з розрідженими газами був встановлений ряд законів, що справедливі для ідеальних газів. Вони розглядаються в шкільному курсі фізики тому ми лише нагадаємо їх.
На основі експериментальних досліджень з розрідженими газами був встановлений ряд законів, що справедливі для ідеальних газів. Вони розглядаються в шкільному курсі фізики тому ми лише нагадаємо їх.
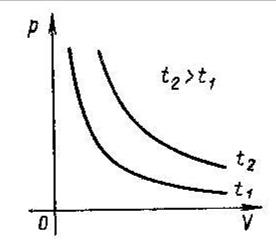
Перший газовий закон відкрив англійський учений Бойль у 1660р. Незалежно від Бойля трохи пізніше, аналогічні дослідження проводив французький учений Маріотт. Він дійшов тих-же висновків, що і Бойль. Тому знайдений закон дістав назву закону Бойля - Маріотта.
Закон Бойля-Маріотта: добуток тиску та об’єму ідеального газу постійний, якщо температура і маса газу не змінюється (ізотермічний процес).
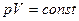 .
.
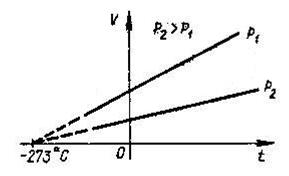
Майже через 150 років у 1802р. були опубліковані праці французького вченого Гей-Люссака. Так світ дізнався про ще один газовий закон.
Закон Гей - Люссака: при постійному тиску об’єм заданої маси ідеального газу прямо пропорційний його абсолютній температурі (ізобарний процес).
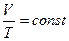 .
.
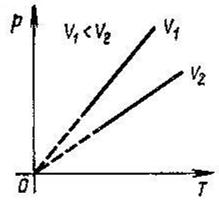 Ще один закон був експериментально встановлений французьким вченим Ж. Шарлем у 1787р.
Ще один закон був експериментально встановлений французьким вченим Ж. Шарлем у 1787р.
Закон Шарля: при постійному об’ємі і масі ідеального газу його тиск прямо пропорційний його абсолютній температурі
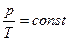 .
.
Після узагальнення цих трьох законів французьким фізиком Клапейроном Б.П. (1799-1864) було отримане рівняння для 1 кг газу
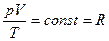 .
.
Де 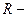 газова стала, Дж/(кг∙ К). Її фізичний зміст: вона показує, що для даної маси ідеального газу відношення добутку тиску і об’єму до абсолютної температури є постійною величиною.
газова стала, Дж/(кг∙ К). Її фізичний зміст: вона показує, що для даної маси ідеального газу відношення добутку тиску і об’єму до абсолютної температури є постійною величиною.
В 1811р. А.Авогадро відкрив закон за яким молі різних газів при однакових температурах і тисках займають однакові об’єми. Тобто при температурі 0ОС і тиску 101325 Па об’єм моля будь-якого газу становить 0, 0224 м3/моль. Після відкриття цього закону стало можливим визначення універсальної газової сталої R для одного моля газу
 4 Дж/(моль К).
4 Дж/(моль К).
Для довільної кількості газу найбільш загальною формою запису рівняння стану ідеального газу є рівняння Менделеева - Клапейрона
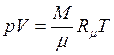 .
.
де М- маса газу, кг;  молярна маса газу, кг/моль; R- універсальна газова постійна, Дж/(моль К). Співвідношення
молярна маса газу, кг/моль; R- універсальна газова постійна, Дж/(моль К). Співвідношення 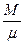 визначає кількість молей газу, що приймають участь у термодинамічному процесі. Густина газу
визначає кількість молей газу, що приймають участь у термодинамічному процесі. Густина газу 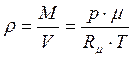 . Наприклад для повітря при
. Наприклад для повітря при 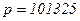 Па,
Па, 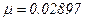 кг/моль одержимо
кг/моль одержимо
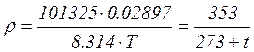
У діаграмах Р – υ і Т– S указані процеси зображуються лініями, показаними на рис. 1.
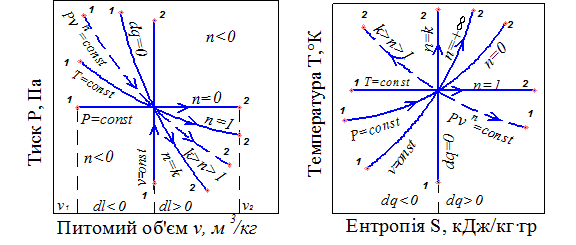
Рис.1. Процеси зміни параметрів ідеального газу в Р– υ та Т– S - координатах
Адіабатний процес характеризується тим, що зміна ентропії в ньому відсутня, Δ S = 0. Тому цей процес називають ізоентропним. Для політропного процесу показник ступеня n змінюється від + ∞ до – ∞.
Визначення основних характеристик процесів проводиться згідно із залежностями, наведеними у таблиці 4. Індекси “к” і “п” у таблиці означають кінцевий та початковий стан робочого тіла.
Аналіз характеристик для різних термодинамічних процесів дає можливість зробити такі висновки:
– в ізохорному процесі робота не виконується, а вся відведена теплота витрачається на зміну внутрішньої енергії
q = Δ U = Сmυ × (Тк – Тп);
– збільшення тиску робочого тіла при υ = сons t приводить до пропорційного підвищення температури РТ;
– теплота, що підводиться до робочого тіла в ізобарному процесі, приводить до збільшення ентальпії і витрачається як на зміну внутрішньої енергії, так і на здійснення роботи
q = ік – іп = Сmр× (Тк – Тп)= l+ Δ U;
– внутрішня енергія та ентальпія при ізотермічному процесі не змінюються. Теплота, підведена до робочого тіла, витрачається тільки на виконання роботи. Ізотермічний процес є одним із найефективніших
Δ Т = 0; Δ U = 0; Δ і = 0; q = l;
– в адіабатному (ізоентропійному) процесі робота виконується в результаті зміни внутрішньої енергії РТ. Зовнішній теплообмін у процесі відсутній
– Δ U =l; dq =0;
– у політропному процесі зміна стану ідеального газу здійснюється при постійному значенні теплоємності, незмінним залишається також розподіл теплоти між роботою і внутрішньою енергією.
Таблиця 4