
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лабораторна робота 1
|
|
МЕТОДИ ВИДІЛЕННЯ І ОЧИЩЕННЯ ОРГАНІЧНИХ РЕЧОВИН
Контрольні питання
1. Які етапи включає процес кристалізації? Вимоги до розчинника. Описати методику перекристалізації.
2. Навіщо додають активоване вугілля при проведенні перекристалізації?
3. Як розрізняють перегонки за умовами проведення? Які типи перегонок ви знаєте? У яких випадках вони застосовуються?
4. Закон Рауля. Відносна леткість.
5. Які рідкі суміші можна поділити?
6. Що таке ректифікація?
7. Закони Коновалова. Азеотропні суміші.
8. Як проводити перегонку при атмосферному тиску?
9. Як проводити сублімацію?
10. Для чого використовується екстракція? Опишіть методику її проведення.
11. Що таке коефіцієнт розподілення?
12. Як працює апарат Сокслета?
13. Для чого при екстракції з водних розчинів добавляють сіль?
Органічні речовини, що виділені із природних джерел (чи одержані синтетично), часто забруднені різними домішками. Ось чому, перш ніж приступити до вивчення органічних сполук, необхідно одержати їх у чистому вигляді.
Для виділення і очищення органічних сполук застосовуються такі методи: кристалізація, сублімація, екстракція, перегонки, хроматографія (на папері, на колонках з адсорбентом, тонкошарова) та ін. Показниками ступеню чистоти одержаної органічної речовини є фізичні константи: температура плавлення (загустівання), температура кипіння (замерзання), питома вага (густина), показник заломлення світла, молекулярна рефракція та ін.
1.1. Кристалізація
Принцип методу. Кристалізація - один з найширше застосовуваних методів очищення твердих речовин, а також розділення, сумішей. Принцип даного методу ґрунтується на різній розчинності речовин в розчиннику залежно від його температури.
Процес кристалізації включає:
1) приготування нагрітого насиченого розчину речовини у відповідному розчиннику;
2) фільтрування гарячого розчину від нерозчинених домішок,
3) охолодження розчину, яке призводить до кристалізації,
4) відділення кристалів від маточного розчину,
5) сушка кристалів.
Для успішного проведення кристалізації важливе значення має правильний вибір розчинника. Одна з головних вимог до розчинника полягає в тому, щоб останній розчиняв речовину, яку потрібно кристалізувати, значно краще при нагріванні, ніж на холоді. Розчинник не повинен розчиняти домішки (в такому випадку їх можна буде відфільтрувати) або, навпаки, повинен розчиняти їх дуже добре (тоді при охолодженні розчину вони не випадуть разом з основним продуктом і залишаться в маточному розчині). Відомості про розчинність органічних сполук можна знайти в довідковій літературі, а якщо такі дані відсутні, то підбирають відповідний розчинник на основі пробних дослідів в пробірках. При цьому треба мати на увазі, що “подібне розчиняє подібне”.
Гарячий розчин, насичений речовиною, яку потрібно кристалізувати, відфільтровують від нерозчинених домішок, потім фільтрат охолоджують. Осад, що випадає при охолодженні, відділяють фільтруванням, промивають свіжим розчинником, а потім сушать. Для більш повного виділення осаду охолодження можна проводити у охолоджуючих сумішах.
При розчиненні органічних сполук, що містять смолисті домішки, останні можуть надати забарвлення розчину. Забарвлені домішки, як правило, ускладнюють кристалізацію основного продукту. Ці домішки за фізико-хімічними властивостями в більшості випадків відрізняються від основного продукту і можуть бути видалені з розчину за допомогою адсорбентів.
Полярні розчинники знебарвлюють активованим вугіллям, яке додають до гарячого розчину в ретельно подрібненому вигляді в кількості 2-5% від ваги речовини, яку кристалізуємо. Температура гарячого розчину при додаванні активованого вугілля повинна бути значно нижче температури кипіння для того, щоб додавання вугілля не спричинило бурхливого кипіння рідини, яке може супроводжуватися викидом. Якщо розчин повністю не обезбарвився, то обробку вугіллям повторюють. Треба мати на увазі, що при обезбарвленні активованим вугіллям, особливо при нагріванні, деякі сполуки легко окиснюються за рахунок кисню, який адсорбувало вугілля. Розчини неіоногенних розчинників, наприклад, гексану, чотирихлористого вуглецю, дихлоретану, бензолу, хлороформу, обезбарвлюють оксидом алюмінію. Їх фільтрують через шар адсорбента, який поміщають у лійку Бюхнера або на скляний фільтр.
Обладнання та матеріали: пробірки; скляні палички; скляна лійка; лійка Бюхнера; колба Бунзена для відсмоктування; складчастий фільтр; фільтр для лійки Бюхнера.
Реактиви: бензойна кислота С6Н5СООН - 0.5 г (або щавлева кислота C2H2O4·H2O –2 г); дистильована вода.
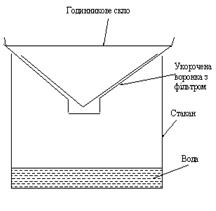
 Виконання кристалізації. У склянку або колбу ємністю на 35 - 50 мл наливають 25 мл води та додають 0, 5 г забрудненої бензойної кислоти, вміст нагрівають до початку кипіння; при цьому бензойна кислота повністю розчиняється. Одночасно, в окремій колбі нагрівають воду, яка знадобиться в подальшому для змивання, а також готують пристрій для гарячого фільтрування: на дно склянки наливають 2 - 3 мл води так, щоб дно склянки було цілком покрите водою і вільно вставляють конічну лійку зі складчастим фільтром; нагрівають воду до кипіння (рис. 1.1).
Виконання кристалізації. У склянку або колбу ємністю на 35 - 50 мл наливають 25 мл води та додають 0, 5 г забрудненої бензойної кислоти, вміст нагрівають до початку кипіння; при цьому бензойна кислота повністю розчиняється. Одночасно, в окремій колбі нагрівають воду, яка знадобиться в подальшому для змивання, а також готують пристрій для гарячого фільтрування: на дно склянки наливають 2 - 3 мл води так, щоб дно склянки було цілком покрите водою і вільно вставляють конічну лійку зі складчастим фільтром; нагрівають воду до кипіння (рис. 1.1).
Після того як пари води обігріють лійку, на фільтр обережно виливають гарячий розчин бензойної кислоти. Колбу, у якій проводилося розчинення, двічі споліскують гарячою водою (по 2 - 3 мл).
Гарячий розчин швидко фільтрують через маленький складчастий фільтр. В процесі фільтрування нерозчинні домішки залишаються на фільтрі.
Одержаний гарячий фільтрат ділять на дві частини (А і Б).

 Фільтрат А швидко охолоджують, занурюючи пробірку у воду з льодом; бензойна кислота випадає при цьому у вигляді маленьких кристалів. Другу частину фільтрату Б залишають повільно охолоджуватися на повітрі (20-25 хвилин); утворюються великі пластинчасті кристали. При роботі з щавлевою кислотою C2H2O4·H2O розчиняють 2 г кислоти в 5 мл води та роблять так само, як описано вище. Щавлева кислота кристалізується у вигляді голок; і в цьому випадку величина кристалів теж залежить від швидкості охолодження.
Фільтрат А швидко охолоджують, занурюючи пробірку у воду з льодом; бензойна кислота випадає при цьому у вигляді маленьких кристалів. Другу частину фільтрату Б залишають повільно охолоджуватися на повітрі (20-25 хвилин); утворюються великі пластинчасті кристали. При роботі з щавлевою кислотою C2H2O4·H2O розчиняють 2 г кислоти в 5 мл води та роблять так само, як описано вище. Щавлева кислота кристалізується у вигляді голок; і в цьому випадку величина кристалів теж залежить від швидкості охолодження.
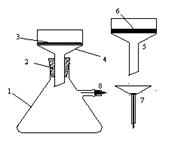
Бензойну або щавлеву кислоту, що випала, відсмоктують на лійці з гвіздком (7) чи на лійці Шота (5), промивають осад невеликим об’ємом води (2-5 мл), знову відсмоктують, переносять осад на листок фільтрувального паперу і віджимають на ньому до суха, сушать на повітрі. Одержують 0, 43 - 0, 45 г чистої бензойної кислоти. Ступінь чистоти бензойної кислоти визначають шляхом визначення температури плавлення (т. пл. 1200С). При необхідності, цю операцію повторюють декілька разів. Залишають одержану речовину для визначення температури плавлення в лабораторній роботі 2.
1.2. Сублімація
Принцип методу. Сублімацію (або возгонку) застосовують для очищення твердих речовин, які при нагріванні минаючи рідку фазу (не плавлячись), переходять у пару, яка при охолодженні легко знову конденсується у твердий стан.
Обладнання та матеріали: стакан, годинникове скло; пісочна баня з джерелом нагрівання; вата.
Реактиви: нафталін; дистильована вода.
Проведення процесу сублімації. В стакан насипають 0, 5-1 г нафталіну і накривають годинниковим склом. Стакан обережно підігрівають на пісочній бані. При цьому пари сублімованого нафталіну охолоджуються на поверхні годинникового скла і осідають на ньому у вигляді кристалів. На скло необхідно покласти вату, змочену холодною водою. Якщо пари виділяються інтенсивно, стакан знімають з пісочної бані. Після охолодження годинникове скло обережно знімають. На ньому видно чисті кристали нафталіну чи іншої речовини. Домішки, які не сублімуються, залишаються в стакані.
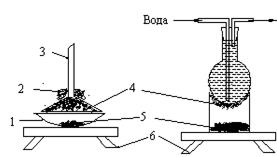 Інші прості пристрої для сублімації при атмосферному тиску зображено на рис. 1.3.
Інші прості пристрої для сублімації при атмосферному тиску зображено на рис. 1.3.
Рис. 1.3. Пристрої для сублімації речовин
1 - порцелянова чашка,
2 – змочена водою вата,
3 – лійка,
4 – сублімована речовина,
5 - речовина з домішками, 6 - електроплитка
Порцелянову чашку накривають лійкою, яка за діаметром трохи менше від чашки. Вузький кінець лійки нещільно закривають ватою, а для того щоб сублімована речовина не попала знову в чашку, її закривають круглим листком фільтрувального паперу з декількома отворами в ньому. На зовнішню сторону лійки можна положити вату, що змочена водою для кращого охолодження.
У другому пристрої для сублімування речовину вміщують у низький стакана без носика і закривають кругло донною колбою, через яку пропускають воду. При високих температурах сублімації вода в колбі може бути і непроточною. В процесі сублімації нагрівати речовину потрібно дуже повільно.