
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Перегонка
|
|
Принцип методу. Перегонка - один з найбільш важливих методів виділення і очищення органічних речовин. При перегонці бінарної суміші речовин А і Б парціальні тиски окремих речовин в паровій фазі (відповідно, рА та рБ) визначаються законами Рауля: парціальний тиск пари даної речовини в паровій фазі над розчином дорівнює добутку тиску пари цієї речовини на її молярну частку в розчині (іншими словами: чим більше концентрація речовини в розчині, тим вище тиск її пари над розчином).
рА = РА × хА (1.1)
р Б = Р Б × х Б(1.2)
де Р А та Р Б – тиск парів чистих компонентів А і Б;
В х А та х Б – молярні частки компонентів А та Б в рідині (х А + х Б = 1).
В бінарній суміші х Б = 1 - х А, і тому співвідношення парціальних тисків в паровій фазі буде таким:
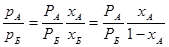 (1.3)
(1.3)
Парціальний тиск в паровій фазі р А та р Б, крім того, зв’язаний з загальним тиском пари р через молярні частки обох компонентів в паровій фазі у А та у Б (у А + уБ = 1):
р А = р × у А, р Б = р × у Б = р (1- у А ) (1.4)
Підстановка значень р А та р Б з рівнянь (1.4) в рівняння (1.3) дає:
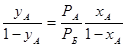 (1.5)
(1.5)
Приймемо, що речовина А є найбільш леткою і тоді її молярну частку в парі та молярну частку в рідині будемо позначати без індексів, відповідно, у та х. Співвідношення тиску парів чистих компонентів Р А /Р Б позначають a і називають відносною леткістю. Якщо в рівняння (1.5) підставити a замість Р А /Р Б, то воно буде мати такий вигляд:
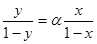 (1.6)
(1.6)
Рівняння (1.6) пояснює залежність між відносною концентрацією легкокип’ячого компонента в парі і в рідині. Можна помітити, що склад пари й рідини розрізняється тільки тоді, коли a> 1. І тільки в цьому випадку є можливим розділити компоненти перегонкою. Збагачення пари легко летким компонентом, з другого боку, тим більше, чим більше a, тобто чим більше розрізняються тиски парів чистих компонентів. Рівняння (6.I) показує те збагачення дистиляту легко летким компонентом, яке може бути досягнуто при однократному випаровуванні.
Якщо речовини, які розділяють, відрізняються за своєю леткістю мало, то їх неможливо добре розділити при однократному процесі випаровування та конденсації, тобто простою перегонкою. В таких випадках процеси випаровування та конденсації повторюють багато разів (ректифікація). Можна керуватися таким емпіричним правилом: ректифікаційна перегонка повинна застосовуватися, коли різниця в температурах кипіння речовин, що розділяють, менша за 80о.
При випаровуванні бінарної суміші з концентрацією більш леткого компонента х1 вміст його в парі зростає відповідно з рівнянням (1.6).
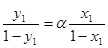 (1.7)
(1.7)
При повній конденсації цієї пари концентрація леткого компоненту, звичайно, не зміниться і в результаті утвориться нова рідка фаза з концентрацією того ж компонента х2 = у1:
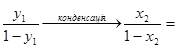
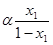 (1.8)
(1.8)
Якщо випаровувати одержану рідину в другий раз, то пара, що утворюється при цьому, буде мати такий склад у2:
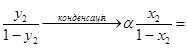
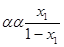 =
= 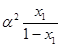 (1.9)
(1.9)
Після n -кратного повторення процесу випаровування та кон-денсації в результаті для складу пари одержують співвідношення: 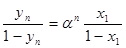 (1.10)
(1.10)
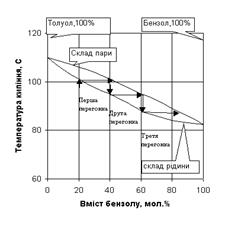 Такий процес багаторазового випаровування та конденсації (ректифікація) здійснюється в ректифікаційних колонках, в яких пара та рідина рухаються протитоком. Як приклад, розглянемо розділення суміші бензол-толуол. Криві залежності складу пари від складу рідини для суміші бензол-толуол наведено на рис. 1.4. У випадку, коли в рідкій суміші бензол-толуол вміст бензолу складає 20 мол. % (нижня крива), то в парах бензолу буде 40 мол. % (для визначення провести пряму паралельну осі абсцис до перетину з верхньою кривою, що показує склад пари). Якщо зібрати таку пару (рідка суміш цих речовин кипить при температурі біля 100оС- для визначення температури кипіння провести пряму паралельну осі ординат від верхньої кривої до перетину з нижньою кривою), то будемо мати суміш, в якій буде 40 мол. % бензолу і 60 мол. % толуолу (перша перегонка), тобто суміш буде збагачена бензолом. Склад пари такої рідкої суміш бензол-толуол буде: 60 мол.% бензолу і 40 мол.% толуолу. Якщо сконденсувати таку пару, то в рідині (вона буде кипіти вже при температурі біля 95оС) буде саме такий склад бензолу та толуолу (друга перегонка).
Такий процес багаторазового випаровування та конденсації (ректифікація) здійснюється в ректифікаційних колонках, в яких пара та рідина рухаються протитоком. Як приклад, розглянемо розділення суміші бензол-толуол. Криві залежності складу пари від складу рідини для суміші бензол-толуол наведено на рис. 1.4. У випадку, коли в рідкій суміші бензол-толуол вміст бензолу складає 20 мол. % (нижня крива), то в парах бензолу буде 40 мол. % (для визначення провести пряму паралельну осі абсцис до перетину з верхньою кривою, що показує склад пари). Якщо зібрати таку пару (рідка суміш цих речовин кипить при температурі біля 100оС- для визначення температури кипіння провести пряму паралельну осі ординат від верхньої кривої до перетину з нижньою кривою), то будемо мати суміш, в якій буде 40 мол. % бензолу і 60 мол. % толуолу (перша перегонка), тобто суміш буде збагачена бензолом. Склад пари такої рідкої суміш бензол-толуол буде: 60 мол.% бензолу і 40 мол.% толуолу. Якщо сконденсувати таку пару, то в рідині (вона буде кипіти вже при температурі біля 95оС) буде саме такий склад бензолу та толуолу (друга перегонка).
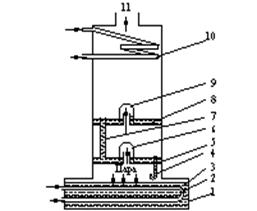
 Відповідно, після такої процедури в третій раз склад рідини буде: 82 мол.% бензолу та 18 мол.% толуолу (температура кипіння такої суміші біля 90оС). Як вказувалося вище, такі послідовні перегоки називають ректифікацією і на практиці здійснюють в одному і тому ж апараті, що зветься ректифікаційною колоною. Ректифікаційна колона, як правило, є трубою великого діаметру (рис. 1.5.), усередині якої знаходяться так звані тарілки, на котрих і відбуваються вказані послідовні перегонки. В даному випадку для того, щоб із суміші, яка містить 20 мол. % бензолу зробити суміш із 82 мол. % бензолу, потрібно лише три тарілки. Аналогічно, маючи діаграму стану для певної суміші, вказаним способом можна розрахувати кількість тарілок для перегонки з одержанням необхідного складу суміші.
Відповідно, після такої процедури в третій раз склад рідини буде: 82 мол.% бензолу та 18 мол.% толуолу (температура кипіння такої суміші біля 90оС). Як вказувалося вище, такі послідовні перегоки називають ректифікацією і на практиці здійснюють в одному і тому ж апараті, що зветься ректифікаційною колоною. Ректифікаційна колона, як правило, є трубою великого діаметру (рис. 1.5.), усередині якої знаходяться так звані тарілки, на котрих і відбуваються вказані послідовні перегонки. В даному випадку для того, щоб із суміші, яка містить 20 мол. % бензолу зробити суміш із 82 мол. % бензолу, потрібно лише три тарілки. Аналогічно, маючи діаграму стану для певної суміші, вказаним способом можна розрахувати кількість тарілок для перегонки з одержанням необхідного складу суміші.
Таким чином, розділення суміші рідин перегонкою можливе в тому випадку, коли утворена при перегонці пара має інший склад порівняно з рідиною. Д.П.Коновалов встановив закони, що характеризують співвідношення між складом рідини і парою над нею, які знаходяться у рівновазі. Згідно першому закону Д.П.Коновалова підвищення відносного вмісту певного компоненту в рідкій фазі завжди призводить до збільшення відносного вмісту його в парі. При цьому в двокомпонентній системі пара (порівняно з рідиною, що є в рівновазі з нею) відносно багатша тим з компонентів, додавання якого до системи 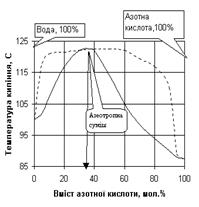 підвищує загальний тиск пари, тобто знижує температуру кипіння суміші при даному тиску.
підвищує загальний тиск пари, тобто знижує температуру кипіння суміші при даному тиску.
 Деякі рідини, що взяті в певних співвідношеннях, утворюютьсуміші, при перегонці яких склад пари ( пунктирна лініяна рис. 1.6. та 1.7. ) не відрізняється від складу рідини.
Деякі рідини, що взяті в певних співвідношеннях, утворюютьсуміші, при перегонці яких склад пари ( пунктирна лініяна рис. 1.6. та 1.7. ) не відрізняється від складу рідини.
 Згідно другому закону Д.П.Коновалова точки максимуму і мінімуму на кривій залежності температури кипіння від складу як раз і відповідає таким розчинам.
Згідно другому закону Д.П.Коновалова точки максимуму і мінімуму на кривій залежності температури кипіння від складу як раз і відповідає таким розчинам.
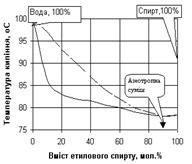
 Як приклад, на рис. 1.6. наведена відповідна діаграма стану для суміші з максимальною температурою кипіння (азотна кислота – вода), а на рис. 1.7 - для суміші з мінімальною температурою кипіння (етиловий спирт-вода). Суміші, що переганяються без зміни складу і температури кипіння, тобто без розділення, називаються нероздільно киплячими або азеотропними.
Як приклад, на рис. 1.6. наведена відповідна діаграма стану для суміші з максимальною температурою кипіння (азотна кислота – вода), а на рис. 1.7 - для суміші з мінімальною температурою кипіння (етиловий спирт-вода). Суміші, що переганяються без зміни складу і температури кипіння, тобто без розділення, називаються нероздільно киплячими або азеотропними.
Способи перегонки розділяються на дві групи: проста перегонка і ректифікація.
За умовами проведення розрізняють три види перегонки:
а) при атмосферному тиску,
б) при зменшеному тиску (перегонка у вакуумі)
в) з водяною парою.