
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лабораторна робота 9
|
|
ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ
Контрольні питання
1. Поясніть чому піридин має властивості основи, а пірол – властивості слабкої кислоти. Наведіть схеми реакцій, що підтверджують це.
2. Чим відрізняється перебіг реакцій електрофільного заміщення для піридину і п’ятичленних гетероциклів з одним гетероатомом? Наведіть приклади.
3. Наведіть приклади і поясніть механізм реакції нуклеофільного заміщення в піридині.
4. Одержання хіноліну
5. Синтез індолу за Фішером.
6. Одержання індіго.
7. Одержання і властивості п’ятичленних гетероциклів з декількома гетероатомами.
8. Одержання і властивості шестичленних гетероциклів з декількома гетероатомами.
9. Поясніть хімізм кубового фарбування.
10. За якими фізичними властивостями можна відрізнити індіго від індігокарміну?
11. Опишіть методику одержання фурфуролу і хімізм процесу.
Гетероциклічні сполуки - це органічні речовини, що містять у своїх молекулах цикли, в утворенні яких крім атомів вуглецю беруть участь атоми інших елементів (гетероатоми).
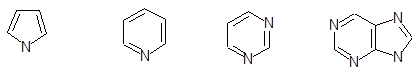
Найбільш поширені гетероцикли, до складу яких входять атоми азоту, кисню або сірки.
Пірол Піридин Піримідин Пурин
Атом азоту в гетероциклах є зв'язаним з вуглецевими атомами, тому такі сполуки можна розглядати як циклічні аміни.
Піридин С5H5N – шестичленний гетероцикл з одним атомом азоту.
Електронна будова молекули піридину подібна до будови бензолу. Атоми вуглецю й азоту знаходяться в стані sp 2-гібридизації. Усі σ -зв'язки C–C, C–H і C–N утворені гібридними орбіталями, кути між ними складають приблизно 1200. Тому цикл має плоску будову. Шість електронів, що знаходяться на негібридних р-орбіталях, утворюють π -електронну ароматичну систему.
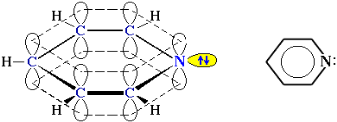
З трьох гібридних орбіталей атома азоту дві утворюють σ -зв'язки С-N, а третя містить неподілену пару електронів, яка не бере участь у π -електронній системі. Тому піридин, подібно амінам, виявляє властивості основи. Його водний розчин забарвлює лакмус у синій колір. При взаємодії піридину із сильними кислотами утворюються солі піридинію.
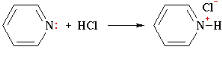
Поряд з основними властивостями піридин виявляє властивості ароматичної сполуки. Однак його активність у реакціях електрофільного заміщення нижче, ніж у бензолі. Це пояснюється тим, що азот як більш електронегативний елемент відтягує електрони на себе і знижує густину електронної хмари в кільці, особливо в положеннях 2 і 4 (орто - і пара-положення). Тому, наприклад, реакція нітрування піридину проходить у жорстких умовах (при 300 C) і з низьким виходом. Орієнтуючий вплив атома азоту на вступ нового замісника при електрофільному заміщенні в піридині є подібним до впливу нітрогрупи в нітробензолі: реакція йде в положення 3.
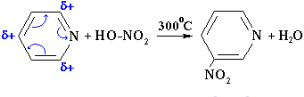
Як і бензол, піридин може приєднувати водень у присутності каталізатора з утворенням насиченої сполуки піперидину.
Піперидин виявляє властивості вторинного аміну (сильна основа).
Фурфурол