
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Материальный и тепловой балансы кристаллизации
|
|
Общий материальный баланс кристаллизации описывается формулой
Gн = Gкр + Gм+W (17.6)
где: Gн, Gкр, Gм - массы соответственно исходного раствора, полученных кристаллов и маточного раствора, кг; W - масса удаленной воды, кг.
Баланс по абсолютно сухому растворенному веществу
Gнxн=Gкрa+Gмxм
где: хн, хм — концентрации соответственно исходного и маточного растворов, массовые доли; а=М/Мкр - отношение молекулярных масс абсолютно сухого растворенного вещества и кристаллосольвата, при кристаллизации без присоединения молекул воды М=Мкр; а= 1.
Массу удаленного растворителя при, а= 1находят по формуле
W=Gкр / Gн (1– хн / хм) (17.7)
Массу образовавшихся кристаллов определяют совместным решением уравнений (17.6) и (17.7):
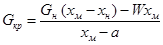 (17.8)
(17.8)
При испарении воды в воздух масса сухого воздуха (в кг) определяется из уравнения L=W(x2-x1), где х2 и х1 - соответственно конечное и начальное влагосодержание воздуха, кг влаги на 1 кг сухого воздуха.
В случае кристаллизации без отгонки растворителя (W=0)
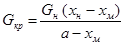 (17.9)
(17.9)
При а= 1
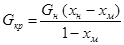 (17.10)
(17.10)
Рассмотрим кристаллизацию с отгонкой части воды. На кристаллизацию поступает исходный раствор Gн, из которого образуется G кркристаллов и Gм маточного раствора.
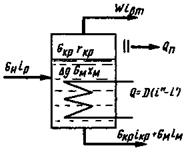 Для отгонки растворителя в кристаллизатор подается D греющего пара (рис. 17.2).
Для отгонки растворителя в кристаллизатор подается D греющего пара (рис. 17.2).
Рис. 17.2. Схема тепловых потоков
Введем обозначения: i р, i кр, iм, iвт, 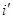 ,
, 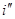 - удельные энтальпии соответственно раствора, кристаллов, маточного раствора, вторичного пара, греющего пара и конденсата, кДж/кг; r кр - теплота образования кристаллической решетки кристаллов, кДж/кг; Δ q- тепловой эффект концентрирования раствора от хи до хм.
- удельные энтальпии соответственно раствора, кристаллов, маточного раствора, вторичного пара, греющего пара и конденсата, кДж/кг; r кр - теплота образования кристаллической решетки кристаллов, кДж/кг; Δ q- тепловой эффект концентрирования раствора от хи до хм.
При кристаллизации раствора происходит образование кристаллической решетки и выделяется некоторое количество теплоты (теплота затвердевания), а при растворении вещества требуются затраты теплоты. Если растворяемое вещество вступает в химическое взаимодействие с растворителем с образованием гидратов, при этом выделяется теплота. Суммарной тепловой эффект кристаллизации в зависимости от теплоты затвердевания и образования гидратов может быть положительным или отрицательным.
С учетом введенных обозначений теплота кристаллизации Q кр =Q кр r кртеплота гидратации Qr = ±Δ qG м x м
Согласно схеме тепловых потоков (см. рис. 17.2) тепловой баланс можно представить равенством
G н i р + G к.р r к.р ± Δ qG м x м + Di" =G кр i кр +G м i м +Wi вт +D 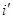 +Q п (17.11)
+Q п (17.11)
откуда можно определить расход пара на кристаллизацию по уравнению
Q=D ( )=
)= 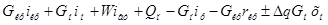 ;
;
D=Q/ ( )
)
В случае охлаждения раствора массовый расход:
охлаждающей воды 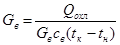 (17.12)
(17.12)
охлаждающего воздуха 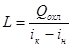 (17.13)
(17.13)
где: i к, i н — соответственно конечная и начальная температуры воды, °С; i к, i н — соответственно конечная и начальная энтальпии воздуха, кДж/кг.
Лекция 35 Кинетика кристаллизации. Классификация и конструкции кристаллизаторов