
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Наиболее полную информацию о поверхностных явлениях даёт объединённое уравнение 1-го и 2-го законов термодинамики
|
|
dGp, T = -SdT + Vdp + σ ds + ∑ μ idni + φ dq,
где dGp, T –энергия Гиббса; S – энтропия; μ i – химический потенциал i – го компонента;
φ – электрический потенциал, В; q – количество электричества, Кл
Мерой удельной свободной энергии является величина поверхностного натяжения – σ;
мерой способности вещества понижать поверхностное натяжение является величина
g = - dσ /dc, называемая поверхностной активностью
Поверхностно-активные вещества (ПАВ) понижают поверхностное натяжение; g > 0
Поверхностно-инактивные вещества (ПИАВ) - электролиты - повышают поверхностное натяжение; g < 0.
Вещества, не изменяющие поверхностное натяжение, называются поверхностно-неактивными (ПНВ); g = 0
Таблица 2
Классификация поверхностных явлений
| Тип поверхностного явления | Постоян- ные параметры системы | Вид термодина- мического уравнения | Энергия, в которую переходит поверхностная энергия |
| Изменение степени дисперсности и реакционной способности | T, p, ni, qi | σ ·ds = dG | свободная поверхностная энергия |
| адсорбция | T, p, q, G | σ ·ds = -∑ μ i·dni | Химическая энергия |
| Адгезия Смачивание | р, ni, qi, G | σ ·ds =S·dT | теплота |
| Электрические явления | T, p, ni, G | σ ·ds =-φ ·dq | Электрическая энергия |
| Капиллярные явления | T, ni, qi, G | σ ·ds =-V·dp | Механическая работа |
Способы выражения поверхностного натяжения:
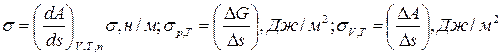 | |||
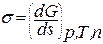 |
Большинство поверхностных явлений обусловлено сорбцией – гетерогенным процессом самопроизвольного поглощения твёрдым телом или жидкостью веществ из внешней среды.
Вещество (ион), которое адсорбируется на поверхности называется адсорбат, а вещество, на поверхности которого происходит адсорбция, называется адсорбент.
Адсорбция происходит за счёт связывания растворённых частиц с поверхностью силами Ван-дер-Ваальса, водородными связями, ионными и, реже, ковалентными связями. Например, нефть с диатомитовыми землями связывается силами Ван-дер-Ваальса, а ионы металлов с каолинитом – когда заряд поверхности противоположен заряду адсорбируемой частицы - ионными связями. Силы Ван-дер-Ваальса обусловливают адсорбцию малополярных органических веществ на незаряженных или слабо заряженных поверхностях (например, на диоксиде кремния). Адсорбция за счёт водородных связей образуется на поверхностях, имеющих группировки Si-O-Si или ОН – группы (цеолиты).
Растворённые ионы металлов адсорбируются, как правило, за счёт ионной связи. При этом, чем больше заряд иона и меньше радиус, тем сильнее адсорбция. Исключение составляет ситуация, когда ион – адсорбат хорошо умещается в кристаллической решётке адсорбента. Поэтому на некоторых силикатных минералах ион К+ адсорбируется гораздо сильнее, чем ион Mg2+, хотя заряд последнего больше.
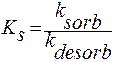 Сорбция – обратимый процесс, характеризуемый своей константой равновесия:
Сорбция – обратимый процесс, характеризуемый своей константой равновесия:
 |
Сорбент + сорбат сорбционный комплекс (сорбтив);
| Сорбция | ||
| Адсорбция | Абсорбция | |
| Диффузия вещества к поверхности и кон -центрирование на поверхности сорбента | Диффузия вещества вглубь сорбента | |
| Адсорбция | ||
| физическая | химическая | |
| для живых существ - смешанная | ||
Количественной характеристикой адсорбции является величина удельной адсорбции – Г:
-равновесное количество поглощаемого вещества, приходящееся на единицу поверхности или единицу массы твёрдого сорбента (в моль/г или моль/м2).
Термодинамически адсорбцию описывает изотерма адсорбции, характеризующая зависимость количества вещества от его равновесной концентрации в растворе. Наиболее распространена изотерма Лэнгмюра:
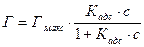 , где Кадс º Кs (л/моль); с – равновесная молярная концентрация вещества над сорбентом (моль/л); Гмакс – число адсорбционных центров на единицу поверхности (единицу массы) сорбента в моль/г или моль/м2.
, где Кадс º Кs (л/моль); с – равновесная молярная концентрация вещества над сорбентом (моль/л); Гмакс – число адсорбционных центров на единицу поверхности (единицу массы) сорбента в моль/г или моль/м2.
По Лэнгмюру, адсорбция характеризуется двумя параметрами: количеством адсорбционных центров - Гмакс (стехиометрия взаимодействия) и константой адсорбции - Кадс (характеризует силу связывания, то есть «качество» адсорбционных центров) (рис.1):
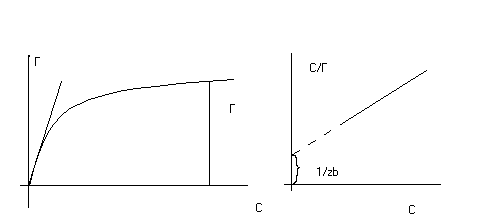
Рис. 1 Изотерма Лэнгмюра
Из рис.1 видно, что при повышении равновесной концентрации адсорбция увеличивается линейно, но по мере заполнения адсорбционных центров, увеличение замедляется и при максимальном насыщении адсорбата адсорбентом переходит в прямую, параллельную оси абсцисс. Линейный участок изотермы (заполнено незначительное количество адсорбционных центров) описывает изотерма Генри – Г = Кн× с, где Кн =Кадс× Гмакс –константа Генри (тангенс угла наклона). Такая ситуация характерна для загрязняющих веществ, концентрация которых незначительна.
Важной характеристикой твёрдых адсорбентов является удельная поверхность – Sуд (м2/г):
У непористых сорбентов Sуд = 0, 01 – 10 м2/г; У пористых сорбентов Sуд =103 – 105 м2/г
(оксиды металлов, соли, сажа) (активированный уголь, силикагель, цеолиты)
Адсорбенты подразделяются на:
| Неполярные | Полярные |
| гидрофобные – сажа, активированный уголь, тальк, фторопласт; цеолиты. | гидрофильные - активированный уголь, силикагель (SiO2)n; алюмогель (Al2O3)n; глины. |
От площади поверхности адсорбентов зависит число адсорбционных центров, поэтому глины являются гораздо более эффективными адсорбентами, чем пески.
Химическая поглотительная способность почв – образование нерастворимых или малорастворимых солей в почвенных растворах. Часто такая способность почв проявляется в карбонатном горизонте при образовании кальцита – СаСО3. При внесении в почву фосфорных удобрений, например суперфосфата Са(Н2РО4)2, возможно образование нерастворимых солей железа FePO4 или кальция Са3(РО4)2.