
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Номенклатура. В настоящее время принято пользоваться номенклатурой, рекомендованной IUPAC (ИЮПАК) в 1961г (Международный союз теоретической и прикладной химии)
|
|
В настоящее время принято пользоваться номенклатурой, рекомендованной IUPAC (ИЮПАК) в 1961г (Международный союз теоретической и прикладной химии). В основе этой номенклатуры - разделение элементов на электроположительные и электроотрицательные (катионы и анионы): в формулах сначала записывают катион, потом - анион, элементы располагают в порядке увеличения электроотрицательности.
Исключением из этого правила является использование в формулах устойчивых группировок, радикалов и традиционных формул (, OH·, NH3, N2H4, Fe(OH)SO4; в кислотах на первое место всегда ставят водород, независимо от электроотрицательности других элементов). При построении названий соединений часто исходят из традиционных названий кислот и анионов, в которых используются суффиксы, указывающие на степень окисления кислотообразующего элемента: -н-, -ов-, -ев – высшая или единственная степень окисления; -новат – промежуточная +5; -ов-, -ист – промежуточная +3 или +4;
-новатист – низшая +1.
Кислоты с максимальным содержанием воды в расчете на одну структурную единицу соответствующего оксида имеют приставку орто-, а с минимальным – мета- (см. табл. 1).
В солях со сложным анионом окончание -ат используется при одной степени окисления у кислотообразующего атома соответствующего аниона, -ит – при более низкой (из двух), приставка гипо- – для низшей степени окисления из трех и более возможных, пер- – для самой высокой из четырех возможных. Сохраняются имеющиеся в кислотах приставки мета-, орто-, ди-, три-, тетра- и т.д. У основных солей к аниону добавляется слово гидроксо -, а у кислых - гидро- (табл.1.1).
Систематические названия веществ по формулам основывается на простых правилах ИЮПАК, имеющих, правда, множество исключений.
1. Названия формул в русском варианте номенклатуры ИЮПАК произносятся справа налево (в английском - наоборот). 
2. Для электроотрицательных элементов в соединениях используются чаще всего латинские названия, а для катионов – русские; электроположительные элементы в составе анионов чаще называются по латыни.
3. Количество атомов элемента (или групп атомов) указывается греческими цифрами (ди-, три-, тетра-, пента-, гекса-, гепта-, окта-, нона-, дека-, и т. д.). Числительное моно- обычно не используется.
4. Для бинарных и псевдобинарных соединений электроотрицательная часть имеет окончания - ид (CuS - сульф ид меди.
5. Сложные анионы имеют окончания -ат; K2SO4- сульф ат калия.
6. В названиях высококоординированных частиц атомы или группы атомов, окружающих центральный атом, называют с окончанием - о: (K3[CoF6] - гексафтор о кобальтат трикалия).
7. Рекомендуется использовать традиционные (тривиальные) названия веществ, например: NH3 - аммиак, H2O - вода (аква), О3 - озон, Н2О2 - пероксид водорода, О2- - надпероксид-ион, NH4+ - аммоний-катион, VO2+ - ванадил-катион и др.
Таблица 1.1.
Названия кислот и анионов их солей
| Кислота | Название кислоты | Название соли |
| HAlO2 | Метаалюминиевая | Метаалюминат |
| H3AlO3 | Ортоалюминиевая | Ортоалюминат |
| HasO3 | Метамышьяковая | Метаарсенат |
| H3AsO4 | Ортомышьяковая | Ортоарсенат |
| HasO2 | Метамышьяковистая | Метаарсенит |
| H3AsO3 | Ортомышьяковистая | Ортоарсенит |
| HBO2 | Метаборная | Метаборат |
| H3BO3 | Ортоборная | Ортоборат |
| HBr | Бромоводородная | Бромид |
| HBrO | Бромноватистая | Гипобромит |
| HBrO3 | Бромноватая | Бромат |
| HCOOH | Муравьиная | Формиат |
| CH3COOH | Уксусная | Ацетат |
| HCN | Циановодородная | Цианид |
| H2CO3 | Угольная | Карбонат |
| HCl | Хлороводородная | Хлорид |
| HClO | Хорноватистая | Гипохлорит |
| HClO2 | Хлористая | Хлорит |
| HClO3 | Хлорноватая | Хлорат |
| HClO4 | Хлорная | Перхлорат |
| HCrO2 | Метахромистая | Метахромит |
| H3CrO3 | Ортохромистая | Ортохромит |
| H2CrO4 | Хромовая | Хромат |
| H2Cr2O7 | Двухромовая | Дихромат |
| HF | Фтороводородная | Фторид |
| HI | Иодоводородная | Иодид |
| HIO4 | Иодная | Иодат |
| HMnO4 | Марганцовая | Перманганат |
| HNO2 | Азотистая | Нитрит |
| HNO3 | Азотная | Нитрат |
| H3PO4 | Ортофосфорная | Ортофосфат |
| HPO3 | Метафосфорная | Метафосфат |
| H2S | Сероводородная | Сульфид |
| H2SO3 | Сернистая | Сульфит |
| H2SO4 | Серная | Сульфат |
| H2SiO3 | Метакремниевая | Метасиликат |
| H4SiO4 | Ортокремниевая | Ортосиликат |
Пример 5`. Назвать следующие соединения: I2O5, HIO4, H5IO6, KIO3.
Решение. I2O5 - оксид иода (V) или пентаоксиддииода (рекомендовано первое название); HIO4 - метаиодная кислота (традиционное название - по аналогии с хлорной
(табл. 1.1);
H5IO6 - ортоиодная кислота или гексаоксоиодат пентаводорода; KIO3 - традиционное название - иодат калия, систематическое - триоксоиодат калия (рекомендуется первое).
Пример 6. Написать формулы следующих веществ:
а) пероксосульфат дикалия; б) пертрисульфиддиаммония; в) триоксотиосульфат динатрия.
Решение. а) пероксосульфат дикалия - K2SO3(O2) или K2SO5 - содержит пероксогруппу 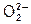 и серу в высшей степени окисления;
и серу в высшей степени окисления;
б) пертрисульфиддиаммония - (NH4)2S3, содержит цепочку (приставка пер-) из трех атомов серы.
в) N2S2O3 - содержит серу в степени окисления -2 (тио-) и серу в высшей степени окисления, то есть в сульфат-ионе один ион О2- заменен на S2-. Это название не рекомендовано правилами ИЮПАК, хотя и отражает состав. Рекомендуется традиционное название - тиосульфат натрия.