
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Пература), кандела (кд, сила света), и моль ( количество вещества).
|
|
Относительные атомные и молекулярные массы (Аr, Мr). Установление стехиометрических законов позволило приписать атомам химических элементов строго определенную массу. Массы атомов чрезвычайно малы. Так, масса атома водорода составляет 1, 67.10–27кг, кислорода - 26, 60·10–27 кг, углерода - 19, 93·10–27 кг. Пользоваться такими числами при различных расчетах очень неудобно. Поэтому с 1961 года за единицу массы атомов принята 1/12 массы изотопа углерода 12С - углеродная единица (у.е.) или атомная единица массы (а.е.м.).
Масса у.е. составляет 1, 66043.10–27 кг (1, 66043.10–24 г).
Относительной атомной массой элемента (Аr) называют отношение абсолютной массы атома к 1/12 части абсолютной массы атома изотопа углерода 12С. Аr показывает, во сколько раз масса атома данного элемента тяжелее 1/12 массы атома 12С. Например, Аr кислорода равна:
1 у.е. ¾ 1, 66.10–24 г,
Х ¾ 26, 60.10–24 г. Отсюда Х = 16, 02 у.е.
Это означает, что атом кислорода примерно в 16 раз тяжелее 1/12 массы атома углерода 12С. Относительные атомные массы элементов (Аr) обычно приводятся в периодической таблице Менделеева.
Относительной молекулярной массой (Мr) вещества называется масса его молекулы, выраженная в у.е.
Мr численно равна сумме атомных масс всех атомов, входящих в состав молекулы вещества. Она подсчитывается по формуле вещества. Например, относительная молекулярная масса серной кислоты H2SO4 будет слагаться из:
атомных масс двух атомов водорода 2.1, 00 = 2, 01
атомной массы одного атома серы 1.32, 06 = 32, 06
атомной массы четырех атомов кислорода 4.16, 02 = 64, 08
98, 16
Значит, Мr (H2SO4) равна 98, 16, или, округленно, 98 у.е. Это означает, что масса молекулы серной кислоты в 98 раз больше а.е.м.
Относительные атомные и молекулярные массы - величины относительные, а потому - безразмерные.
Кроме рассмотренных величин, в химии чрезвычайное значение имеет особая величина - количество вещества. Количество вещества определяется числом структурных единиц (атомов, молекул, ионов или др.) этого вещества и выражается в молях.
Моль - это количество вещества, содержащее столько структурных или формульных единиц, сколько атомов содержится в 12 г изотопа 12С.
Понятие “моль” распространяется на любые структурные единицы (это могут быть реально существующие частицы, такие как атомы (К, О, С), молекулы (Н2, СО2), катионы (К+, Са2+), анионы (СО32-, I–), радикалы (ОН·, NO·2), формульные единицы (КОН, ВеSO4), электроны и другие.
Экспериментально установлено, что в 12 г изотопа 12С содержится
6, 02× 1023 атомов (постоянная Авогадро, NА); ее размерность - моль–1. При использовании понятия “моль” надо указывать, какие структурные единицы имеются в виду.
Например, 1 моль атомов Н содержит 6, 02·1023 атомов, 1 моль молекул Н2О содержит 6, 02·1023 молекул, 1 моль ионов Н+ содержит 6, 02·1023 ионов и т. д. Количество вещества обозначается буквой n.
Отношение массы вещества (m) к его количеству (n) представляет собой молярную массу вещества:
М = 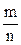 г/моль. (1.1)
г/моль. (1.1)
Отсюда n = 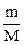 (моль). (1.2)
(моль). (1.2)
Молярная масса вещества численно равна относительной молекулярной массе этого вещества (Мr), выраженной в атомных единицах массы (а.е.м.). Так, молекула Н2О имеет массу (Мr) 18 а.е.м., а 1 моль Н2О (т.е. 6, 02·1023 молекул) имеет массу 18 г. 
Пример 1. Какому количеству вещества соответствует 56 г азота и сколько молекул азота содержится в этом количестве?
Решение. Молярная масса азота (N2) равна 28 г/моль. Следовательно, 56 г азота соответствуют двум молям. Моль любого вещества содержит 6, 02× 1023 структурных единиц, следовательно, в двух молях азота содержится 12, 04× 1023 молекул.
Пример 2. В результате реакции железа с серой получено 22 г сульфида железа (II). Какое количество сульфида железа соответствует этой массе?
Решение. Молярная масса сульфида железа (II) - FeS - равна 88 г/моль.
Используя формулу (1.2), определим количество FeS: n 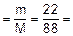 0, 25 моль.
0, 25 моль.
Пример 3. Каковы масса и количество воды, которые образовались при сгорании 8 г водорода?
8 г Х г
Решение. Запишем уравнение реакции: 2Н2 + О2 = 2Н2О
4 г 2.18 г
Записываем молярные массы: М(Н2) = 2 г/моль; М(Н2О) = 18 г/моль.
Вычисляем массу воды по уравнению: из 4 г водорода получается 36 г воды
из 8 г получается Х г
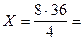 72 г воды.
72 г воды.
По формуле (1.2) находим количество воды: n = 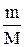 =
= 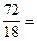 4 (моль Н2О).
4 (моль Н2О).