
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Корпускулярно-волновое описание движения электрона в атоме
|
|
До конца ХIХ века полагали, что атом неделимая и неизменяющаяся частица. Открытие радиоактивности некоторых элементов (А. Беккерель, 1896 г. уран) и объяснение ее расщеплением ядер атомов (Э. Резерфорд, Ф. Содди, 1903 г.), а также открытие электрона, как составной части атома (Дж. Стоней, 1881 г; Дж. Томсон, 1897 г.), доказали сложное строение атома.
Было экспериментально доказано (Э. Резерфорд, 1911 г.), что атом состоит из положительно заряженного тяжелого ядра, имеющего размеры порядка 10-6 нм и легкой оболочки из отрицательно заряженных электронов, имеющей размеры порядка 10-1 нм (т.е. в 100000 раз больше, чем ядро); масса ядра примерно в 2000 раз больше массы электронов, а заряды ядра и электронной оболочки равны между собой.
Ядро атома, в свою очередь, состоит из положительно заряженных частиц - протонов и незаряженных частиц - нейтронов, имеющих примерно одинаковые массы. При этом абсолютные величины зарядов частиц принято выражать в единицах заряда электрона - 1, 602·10-19Кл = 1 ед. заряда.
Природа элемента, его основные химические свойства определяются числом протонов в ядре, определяющих его заряд Z. Атомы, имеющие одинаковый заряд ядра (или число протонов в ядре), относят к одному и тому же элементу. Атомы одного и того же элемента, имеющие различное число нейтронов в ядре (N), называются изотопами. Например, изотопами элемента кальция (Ca) являются 4020Ca (20p+20n), 4220Ca (20p+22n) и 4320Ca (20p+23 n), (при
этом состав ядра указывают цифрами перед символом элемента: верхний индекс обозначает число протонов и нейтронов (нуклонов) в ядре). Сумму протонов (Z) и нейтронов (N), содержащихся в ядре атома, называют массовым числом (А). Нижний индекс обозначает число протонов (Z), а разность между ними равна числу нейтронов N = A - Z.
Исследования, проведенные в конце ХIХ века и начале ХХ, показали неприменимость законов классической физики для описания поведения микрообъектов. На основе этих исследований была создана новая наука - квантовая (волновая) механика, в основе которой лежат представления о квантовании энергии и двойственной (корпускулярно-волновой) природе микрочастиц.
Квантовый характер света. Для объяснения особенностей спектров нагретых тел немецким ученым М. Планком в 1900 г. была предложена теория, основанная на предположении, что энергия не излучается атомами непрерывно, а испускается отдельными мельчайшими неделимыми порциями – квантами, величина которых зависит от частоты излучаемого света. Энергия кванта (Е) пропорциональна частоте излучения (колебания) n:
Е = hn, (2.1)
где Е – энергия кванта (Дж); 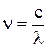 - частота, с-1; l - длина волны излучения (см); h = 6, 626.10-34 (Дж.с) – постоянная Планка (мера дискретности), одна из фундаментальных постоянных, она входит во все квантово-механические соотношения.
- частота, с-1; l - длина волны излучения (см); h = 6, 626.10-34 (Дж.с) – постоянная Планка (мера дискретности), одна из фундаментальных постоянных, она входит во все квантово-механические соотношения.
Согласно уравнению Планка энергия частицы может меняться на величины, кратные hn. Излучая квант света, атом переходит из одного энергетического состояния в другое.
Таким образом, происхождение спектров можно истолковать как результат перехода электронов в атоме между дискретными состояниями, обладающими дискретными значениями энергии.
Корпускулярно-волновые свойства микрообъектов. В попытках объяснить линейчатые спектры атомов и спектр излучения абсолютно черного тела ученые пришли к выводу о двойственной природе электромагнитного излучения и элементарных частиц - они являются одновременно частицами материи (корпускулами) и им соответствует длина волны, которая характеризует их движение. Эту ситуацию в 1924 г. Луи де Бройль (Франция) теоретически описал так: движущаяся частица имеет длину волны
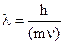 , (2.2)
, (2.2)
где m - масса, v - скорость частицы. В дальнейшем В. Гейзенберг (Германия) истолковал взаимосвязь волновых и корпускулярных свойств элементарных частиц в виде соотношения неопределенностей. Согласно этому принципу невозможно точно определить местонахождение частицы и ее импульс Р=mn в данный момент времени:
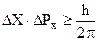 , (2.3)
, (2.3)
которое связано с соотношением Де Бройля (2.2) (координата частицы неопре-деленна в пределах длины волны DХ = l; неопределенность импульса ( 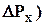 не может быть меньше, чем постоянная Планка; а произведение а произведение неопределенностей координаты и импульса всегда больше элементарного импульса
не может быть меньше, чем постоянная Планка; а произведение а произведение неопределенностей координаты и импульса всегда больше элементарного импульса 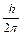 ).
).
В 1927 году были обнаружены у электронов как волновые, так и корпускулярные свойства. Было открыто явление дифракции электронов, т.е. при прохождении пучка электронов через дифракционную решетку на фотопленке наблюдается такая же дифракционная картина, как при прохождении излучения с длиной волны l, рассчитанной по уравнению Луи де Бройля.
Возникла необходимость изменить представление об электроне как о микроскопической заряженной частице, подчиняющейся тем же законам, каким подчиняются макроскопические тела. Возникла необходимость разработки новой теории, применимой к микрочастицам.