
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Нерастворимое вещество; прочерк означает, что вещество не существует или разлагается водой)
|
|
| Катионы | ||||||||||||||||||||||||||||
| Анионы | Li+ K+, Na+ NH4+ Cu2+ Ag+ Mg2+ Ca2+ Sr2+ Ba2+ Zn2+ Hg2+ Al3+ Sn2+ Pb2+ Bi3+ Cr3+ Mn2+ Fe3+ Fe2+ | |||||||||||||||||||||||||||
| Cl- | Р | Р | Р | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Р | Р | Р | Р | |||||||||
| Br- | Р | Р | Р | Р | Н | Р | Р | Р | Р | Р | М | Р | Р | М | - | Р | Р | Р | Р | |||||||||
| I- | Р | Р | Р | - | Н | Р | Р | Р | Р | Р | Н | Р | Р | Н | - | Р | Р | - | Р | |||||||||
| NO3- | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | Р | - | Р | Р | |||||||||
| CH3COO- | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | - | - | Р | - | Р | |||||||||
| S2- | Р | Р | Р | Н | Н | - | Р | Р | Р | Н | Н | - | Н | Н | Н | - | Н | Н | Н | |||||||||
| SO32- | Р | Р | Р | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | - | Н | - | Н | |||||||||
| SO42- | Р | Р | Р | Р | М | Р | М | Н | Н | Р | - | Р | Р | Н | - | Р | Р | Р | Р | |||||||||
| CO32- | Р | Р | Р | - | Н | Н | Н | Н | Н | Н | - | - | - | Н | Н | - | Н | - | Н | |||||||||
| CrO42- | Р | Р | Р | Н | Н | Р | М | М | Н | Н | Н | - | - | Н | Н | Р | Н | - | - | |||||||||
| PO43- | Н | Р | Р | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | |||||||||
| OH- | Р | Р | Р | Н | - | Н | М | М | Р | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | |||||||||
Таблица 8.2
Константы и степени диссоциации некоторых слабых электролитов
| Электролиты | Формула | Числовые значения констант диссоциации | Степень диссоц. в 0, 1Н р-ре, в %. |
| Азотистая к-та | HNO2 | K = 4, 0.10-4 | 6, 4 |
| Аммиак (гидроксид) | NH4OH | К = 1, 8.10-5 | 1, 3 |
| Муравьиная к-та | HCOOH | К = 1, 76.10-4 | 4, 2 |
| К1 = 5, 8.10-10 | 0, 007 | ||
| Ортоборная к-та | H3BO3 | К2 = 1, 8.10-13 | |
| К3 = 1, 6.10-14 | |||
| Ортофосфорная | К1 = 7, 7.10-3 | ||
| кислота | H3PO4 | К2 = 6, 2.10-8 | |
| К3 = 2, 2.10-13 | |||
| Сернистая к-та | H2S03 | К1 = 1, 7.10-2 | |
| К2 = 6, 2.10-8 | |||
| Сероводородная | H2S | К1 = 5, 7.10-8 | 0, 07 |
| кислота | К2 = 1, 2.10-15 | ||
| Синильная кисл. | HCN | К = 7, 2.10-10 | 0, 009 |
| Угольная кислота | H2CO3 | К1 = 4, 3.10-7 | 0, 17 |
| К2 = 5, 6.10-11 | |||
| Уксусная кислота | CH3COOH | К = 1, 75.10-5 | 1, 3 |
| Фтороводородная кислота | HF | К = 7, 2.10-4 | 8, 5 |
Пример 14. Определить рН и рОН 0, 005 М раствора Ca(OH)2.
Решение. Так как щелочь двухосновная, то [OH-] = 2Cщелочи = 0, 01 моль/л. Найдем [H+] по формуле (8.11):
Кв = [Н+]× [ОН-] = 10-14, [H+] = 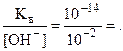 10-12 моль/л.
10-12 моль/л.
pH = -lg [H+] = -lg10-12 = 12, рОН = Kв - pH = 14 - 12 = 2.
Или pOH = -lg [ОH-] = -lg10-2 = 2. Раствор щелочной (рН > 7).
]
Пример 15. Степень диссоциации циановодородной кислоты в сантимолярном растворе (0, 01 М) равна 1% (0, 01). Вычислить константу диссоциации кислоты и водородный показатель раствора.
Решение. Из выражения (8.6) найдем константу диссоциации:
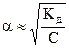
 КД = a2·С = 10-4·10-2 = 10-6.
КД = a2·С = 10-4·10-2 = 10-6.
Найдем водородный показатель из выражения (8.13): рН = -lg [H+].
Концентрацию ионов водорода находим по формуле (8.10):
[Н+] = a·СМ = 10-2·10-2 = 10-4, отсюда рН = - lg [H+] = 4.