
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Опис установки і методу вимірювань
|
|

 Основа приладу (див.рис.162.1) – великий товстостінний балон 1, сполучений гумовими трубками з диференціальним манометром 2 і насосом 3. Кран К у верхній частині балону сполучає балон з навколишнім повітрям.
Основа приладу (див.рис.162.1) – великий товстостінний балон 1, сполучений гумовими трубками з диференціальним манометром 2 і насосом 3. Кран К у верхній частині балону сполучає балон з навколишнім повітрям.
В балон 1, наповнений повітрям при атмосферному тиску, нагнітаємо повітря до деякого нового тиску. Тоді маса повітря в балоні, що займала певний об'єм, стиснеться до тиску Р1 і займатиме певний об'єм V1.

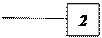 Одночасно при цьому нагрівається стиснена маса повітря. Припинимо накачування і зачекаємо декілька хвилин, доки температура повітря в балоні зрівняється з кімнатною Т1 (I стан повітря). Остаточну різницю рівнів, що встановились у манометрі, позначимо h1, тоді
Одночасно при цьому нагрівається стиснена маса повітря. Припинимо накачування і зачекаємо декілька хвилин, доки температура повітря в балоні зрівняється з кімнатною Т1 (I стан повітря). Остаточну різницю рівнів, що встановились у манометрі, позначимо h1, тоді
P1 = H + h1 .

 Потім відкриємо на короткий час кран K з тим, щоб тиск у балоні зрівнявся з атмосферним P2 = H (при цьому рівні рідини у манометрі зрівнюються). Після цього закриємо кран К. Повітря у балоні швидко розшириться до об'єму V2 (при цьому, зважаючи на малий час розширення, помітного теплообміну між стінками балона і навколишнім повітрям не буде). Температура повітря в балоні зменшиться до T2 (II стан повітря).
Потім відкриємо на короткий час кран K з тим, щоб тиск у балоні зрівнявся з атмосферним P2 = H (при цьому рівні рідини у манометрі зрівнюються). Після цього закриємо кран К. Повітря у балоні швидко розшириться до об'єму V2 (при цьому, зважаючи на малий час розширення, помітного теплообміну між стінками балона і навколишнім повітрям не буде). Температура повітря в балоні зменшиться до T2 (II стан повітря).
Далі чекаємо, доки температура повітря в балоні зрівняється з кімнатною температурою Т1. Об’єм V2 залишиться незмінним, а тиск при нагріванні повітря збільшиться до P3 . Різниця рівнів рідини в манометрі нехай буде h2 і тоді P3 = H + h2 (III стан повітря), де H- атмосферний тиск.
Перехід повітря з I стану в II - адіабатичний. Отже за рівнянням Пуассона
p1V1γ = p2V2γ . (162.6)
Температури повітря в станах I та III дорівнюють одна одній, тому за законом Бойля – Маріотта
p1V1 = p3V2 (162.7)
Розв'язавши (162.6) і (162.7) відносно γ одержимо:
γ = 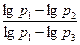 (162.8)
(162.8)
Розклавши lgp1 і lgp3 в ряд Тейлора і обмежившись двома першими членами, матимемо:
lgp1 = lg(H+h1)= lgH + 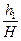 +...;
+...;
lgp3= lg(H+h2)= lgH + 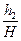 +....
+....
Підставивши одержані результати в (162.8), остаточно матимемо
γ = 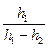 (162.9)
(162.9)
Всі розглянуті процеси в балоні віднесено до певної маси повітря, яке залишається під час досліду в балоні.