
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Строение биологических мембран.
|
|
Первоначальные представления о существовании мембран опирались на физиологические исследования. Первые указания на лимитирующие диффузию свойства клеточной поверхности были получены в середине XIX века К. В. Нагели. Он отметил, что клеточная поверхность является барьером для свободной диффузии красителей внутрь клетки из внеклеточной жидкости. Кроме того, К. В. Нагели обнаружил, что клетки проявляют осмотические свойства.
На основании этих наблюдений он предположил, что существует некая плазматическая мембрана. Используя эритроциты в качестве осмометра, Э. Овертон в конце XIX века выявил тесную взаимосвязь между растворимостью вещества в липидах и его способностью проникать в клетку: чем больше эта растворимость, тем меньший осмотический эффект оказывает вещество. Эти данные явились первым свидетельством того, что мембраны содержат большое количество липидов.
Морфологические данные о существовании клеточной мембраны были получены только после разработки методов приготовления ультратонких срезов тканей, фиксированных химическими методами для проведения электронно-микроскопических исследований. Тонкая структура мембран была исследована с помощью метода замораживания – скалывания.
Первыми авторами, которые предложили модель структурной организации мембраны, были Э. Гортер и Ф. Грендель (1925). Они экстрагировали липиды из теней эритроцитов и приготовляли из них мономолекулярную плёнку на поверхности воды. Амфифильные молекулы липидов распределялись таким образом, что их полярные головки были погружены в воду, а неполярные хвосты торчали наружу. Пленку диспергированных молекул на поверхности воды аккуратно сжимали в латеральном направлении и измеряли силу сжатия. Резкое возрастание этой силы происходило в момент формирования компактного монослоя.
Оказалось, что площадь, занимаемая монослоем, в 2 раза превышала поверхность эритроцитов, взятых для экстракции. Именно это послужило основанием для создания Э. Гортером и Ф. Гренделем концепции липидного бислоя, которая впоследствии легла в основу всех дальнейших представлений о структуре мембран.
Измерение поверхностного натяжения липидного бислоя показало, что оно гораздо больше, чем в мембране эритроцитов, и снижается при добавлении в бислой белков. На основании этих данных в 1931 г. Дж. Ф. Даниэли предложил модель «сэндвича», или унитарную мембранную модель. По его представлению, белки покрывают обе поверхности липидного бислоя, связываясь с ним электростатическими силами. Из расчётов выходило, что белки находятся на мембране в фибриллярной форме. Этой модели неплохо соответствует миелин – мембрана леммоцитов.
Робертсон несколько модифицировал модель Дж. Ф. Даниэлли (1964), предположив, что глобулярные белки находятся на внешней стороне мембраны, а фибриллярные белки – на внутренней.
Однако с термодинамической точки зрения маловероятно, что белок может успешно конкурировать с водой за полярные головки липидных молекул и что слой белка смог бы экранировать их от водного окружения.
Современные методы исследования окончательно опровергли «бутербродную модель» мембраны.
На сегодняшний день общепризнанной является «мозаичная» модель мембраны, предложенная в 1972 г. С. Сингером и Г. Николсоном. Основанием для создания жидкостно–мозаичной модели мембраны послужили данные следующих исследований. Оптические наблюдения показали, что мембранные белки имеют глобулярную структуру (рис. 4.2).
Было установлено, что некоторые белковые молекулы свободно диффундируют в латеральном направлении, т.е. в плоскости мембраны. Исследования с использованием изотопов и др. показали, что белковые молекулы или их части, экспонированные с одной стороны мембраны, отличаются от других, выходящих на другую сторону мембраны.
Согласно этой модели, глобулярные белки интегрированы в липидный бислой; при этом одни из них пронизывают его насквозь, другие лишь частично погружены в бислой. Мембрана является лабильной структурой, все её компоненты имеют возможность осуществлять различные формы подвижности – латеральную диффузию, вращательные движения, «флип-флоп» переходы и другие.
Жидкостно–мозаичная модель, по–видимому, дает наиболее адекватные представления о структурной организации поверхностной мембраны и многих внутриклеточных мембран.
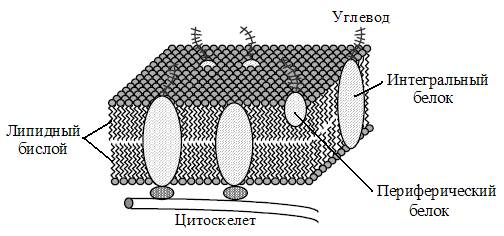
Рис. 4.2. Жидкостно–мозаичная модель биологической мембраны.
Молекула фосфолипида лецитина содержит полярную голову (соединение – производное фосфорной кислоты) и длинный неполярный хвост (остатки жирных кислот). В голове фосфолипидной молекулы имеются две заряженные группы, расположенные на некотором расстоянии друг от друга. Два разноименных заряда, равные по абсолютной величине, образуют электрический диполь.
Полярные головы молекул фосфолипидов гидрофильные, а неполярные хвосты – гидрофобные. В смеси фосфолипидов с водой термодинамически выгодно, чтобы полярные головы были погружены в состоящую из полярных молекул воду, а их неполярные хвосты были бы расположены далеко от воды. Такое расположение амфифильных (имеющих гидрофильную и гидрофобную части) молекул соответствует наименьшему значению энергии Гиббса по сравнению с другими возможными расположениями.
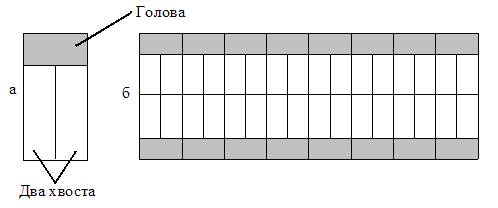
Рис. 4.3. Схематичное изображение «двухвостовой» фосфолипидной молекулы (а) и схема образования бислойной мембраны из таких молекул (б).
Очень существенным является то обстоятельство, что молекулы фосфолипидов имеют два хвоста. Такая молекула в пространстве имеет форму, близкую к цилиндру (рис. 4.3). Из молекул фосфолипидов в водной среде происходит самосборка бислойной мембраны. Присутствие молекул с одним хвостом (лизолецитин), имеющих в пространстве форму, близкую к конусу, разрушает клеточные мембраны (рис. 4.4). Фосфолипидные молекулы, лишенные одного хвоста, образуют поры в мембране. При этом нарушается их барьерная функция.
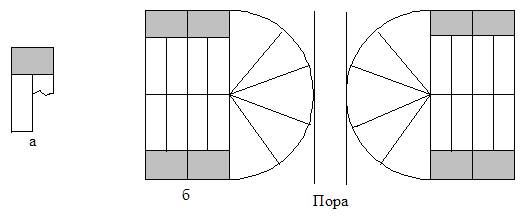
Рис. 4.4. Схематичное изображение «однохвостовой» фосфолипидной молекулы (а) и схема образования поры в мембране из «однохвостовых» молекул (б).
4.3.Липид – липидные взаимодействия. Динамические характеристики расположения липидов в мембране.
Длина растянутой углеводородной цепи жирной кислоты, состоящей из 18 атомов углерода, составляет 2 нм, на полярную головку приходится еще 0, 5–0, 7 нм, следовательно, толщина бислоя липидов должна превышать 4, 0 нм, но в действительности толщина двойного слоя липидов оказывается равной 3, 5–4, 0 нм. Причиной обнаруженного феномена является рыхлое, а не упорядоченное расположение остатков жирных кислот. Раз одна из двух жирных кислот, образующих гидрофобный хвост, ненасыщенная, как правило, увеличивается вероятность образования цис–конформации.
Различные конфигурации молекул жирных кислот, возникающие при поворотах вокруг С–С связей, называют ротамерами или конформерами. Процесс изменения конформации молекул за счет таких поворотов называется транс–гош–изомеризацией (рис. 4.5). Гош–конформация (“гош” – скошенный) аналогична цис− конформации. Вероятность транс–гош–перехода весьма велика и еще более возрастает при увеличении температуры. При переходе из транс– в гош–конформацию образуются складки или кинки (от англ. kink – петля). Такого рода изменения способны захватывать целые кластеры мембранных липидов. Считается, что именно с образованием кинков связан транспорт воды и других веществ через мембраны.
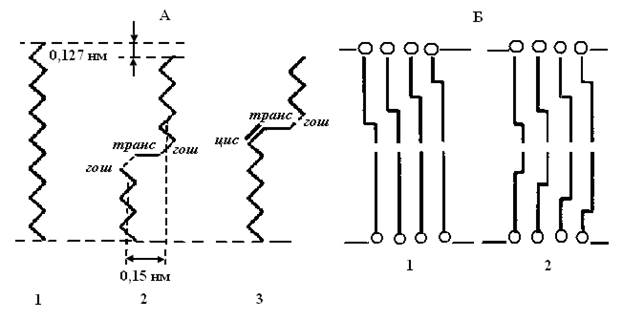
Рис. 4.5. А: 1 – углеводородные цепи полностью в транс–конформации, 2 – в гош–транс–гош–конформации, 3 – в цис–транс–гош–конформации; Б: кинк–блоки в углеводородных цепях мембран: 1 – в одном монослое мембраны; 2 – в двух монослоях липидного бислоя.
Наименьшей энергией обладает транс–, а наибольшей − цис− конформация. Гош – конформации [гош (+) и гош (–) – это поворот на ±120° относительно транс – конформации]. Синоним гош–конформации – скошенная конформация. Он сравнительно мало превышают по энергии транс–конформацию (на 2–3 кДж/моль), но эти состояния разделяет энергетический барьер высотой ~ 12− 17 кДж/моль. Если углеводородные цепи, находящиеся полностью в транс–конформации представляют собой линейные структуры, то появление одиночной гош–конформации в цепи приводит к искривлению пространственной конфигурации цепи на угол ~ 20°. В плотно упакованных мембранных системах с полностью транс–конформацией углеводородных цепей это искривление порождает серьезные стереохимические затруднения, делающие невозможным появление одиночных гош–конформаций.
Уменьшение стереохимических затруднений при плавлении углеводородных цепей в мембранах достигается при синхронном появлении в цепи сразу двух гош-конформаций [гош (+) и гош (–)], разделенных одиночной С − С–связью в транс–конформации. Хотя энергия такого состояния вдвое выше одиночной гош–конформации, возникает ротационное состояние цепи. Оно не вызывает сильного расширения решетки, так как при последовательном повороте цепи на +120 и –120° пространственная конфигурация цепи в целом сохраняется прямолинейной (рис. 4.5, А).
Образование кинка сопровождается уменьшением эффективной длины цепи на ~ 0, 127 нм. При этом часть цепи отодвигается на ~ 0, 15 нм, образуя свободный объем, а занимаемый молекулой липида общий объем увеличивается на 0, 025–0, 050 нм3. Хотя появления одного кинка в углеводородной цепи недостаточно для ее плавления, однако одиночные кинки облегчают возникновение кинков в соседних углеводородных цепях, формируя чередующиеся кинк–блоки (рис. 4.5, Б). Такие блоки могут возникать либо в одном монослое мембраны, либо в двух противоположно расположенных углеводородных слоях (в бислое). При увеличении числа кинков в углеводородных цепях неупорядоченность углеводородной зоны мембран резко нарастает.
Двойные (цис–) связи в жирнокислотных ненасыщенных цепях мембран могут играть роль зародышей образования кинков в соседних насыщенных цепях. В этом случае для образования кинка в ненасыщенной цепи необходимо появление лишь одной гош–конформации при искривлении цепи на 80°. При этом устраняются стереохимические затруднения, возникающие при размещении ненасыщенной цепи в углеводородной зоне мембран из насыщенных липидов. Это хорошо согласуется с экспериментально наблюдаемым резким снижением температуры фазового перехода мембран из насыщенных липидов при добавлении к ним небольших количеств ненасыщенных жирнокислотных цепей – мембрана становится более рыхлой.
Липиды способны совершать вращательные движения вокруг оси молекулы (вращательная диффузия), перемещаться в пределах одного слоя (латеральная диффузия), а также перемещаться из одного слоя в другой (трансмембранный переход или «флип–флоп») (рис. 4.6). Наибольшую скорость имеют вращательная и латеральная диффузия. Например, коэффициент латеральной диффузии составляет 1, 8·10− 8 см2·с− 1. Это соответствует частоте парных перестановок соседних молекул 107 с− 1. Наиболее медленным процессом является «флип–флоп», что связано с высоким уровнем энергии, необходимой для проталкивания заряженных полярных головок через средний углеводородный слой мембраны. Поперечная диффузия молекул фосфолипидов на расстоянии 5 нм занимает в 109 раз больше времени, чем диффузия на то же расстояние в латеральном направлении.
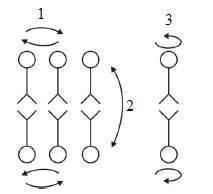
Рис. 4.6. Виды диффузии липидов в мембране. 1 – латеральная диффузия; 2 – трансмембранный переход или «флип–флоп»; 3 – вращательная диффузия.
Сочетание быстрой диффузии молекул липидов вдоль мембраны и медленной диффузии поперек мембраны имеет большое значение для функционирования мембран. Благодаря этому поддерживается упорядоченность в молекулярной структуре мембраны, определенная ориентация белков поперек мембраны, что имеет значение для направленного переноса веществ через мембрану, кроме того, обеспечивается асимметрия бислоя липидов. Функциональная асимметрия мембраны – один из важнейших аспектов, характеризующих липид–липидные взаимодействия. Асимметрия бислоя означает, что состав липидов каждого из слоев неодинаков.