
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Тема 2. Скорость химических реакций и методы ее регулирования
|
|
Рекомендуемая литература: [1], гл. 6, 6.2; [2], гл. 7; [5], гл. V.
Скорость химических реакций отражает число актов химического взаимодействия, происходящих в единице объема (для гомогенных реакций) или на единице поверхности раздела фаз (для гетерогенных реакций) в единицу времени.
Средняя скорость химического процесса выражается изменением концентрации (Δ С) веществ – реагентов или продуктов реакции в единицу времени.
Полная последовательность всех элементарных стадий в процессе взаимодействия отражает механизм химических реакций.
Число частиц, участвующих в каждом элементарном химическом акте, показывает молекулярность реакции.
Главные факторы, влияющие на скорость реакции: природа реагентов; их агрегатное состояние; концентрация реагентов; давление (для реакций с участием газов), температура, специальные факторы (катализ, инициирование, ингибирование), площадь раздела фаз (для гетерогенных реакций).
Влияние концентрации. Химическое взаимодействие веществ возникает лишь при активном столкновении их молекул, поэтому, чем больше концентрация реагирующих веществ, тем выше вероятность активных столкновений и, следовательно, скорость реакции. Зависимость скорости реакции от концентрации выражается з аконом действия масс:
Скорость гомогенной химической реакции при данной температуре прямо пропорциональна произведению концентраций реагирующих веществ или парциальных давлений газообразных веществ, взятых в степенях, равных их стехиометрическим коэффициентам.
Для гомогенной реакции общего вида аА + bВ = сС (А и В – реагенты, С – продукт реакции, а, b и с – стехиометрические коэффициенты), протекающей в истинных растворах, выражение ее скорости описывается уравнением:
V = k· [A]а·[B]b или V = k · CaA · CbB, моль/л·с,
где [A], [B] или CA, CB – молярные концентрации веществ А и В, (моль/л); k – коэффициент пропорциональности, называемый константой скорости.
Для этой же реакции, протекающей в газовой фазе, скорость реакции будет выражена уравнением:
V = k · РaA · РbB, моль/л·с,
где РaA и РbB – парциальные давления веществ А и В.
Константа скорости – это скорость реакции при концентрациях реагирующих веществ, равных единице. Константа скорости зависит от химической природы веществ, температуры и специального фактора (присутствия катализатора, инициатора или ингибитора), но не зависит от концентрации реагирующих веществ или создаваемого ими парциального давления (в газовых реакциях).
Скорость гетерогенной реакции не зависит от концентрации твердого вещества, потому что такая реакция проходит только на поверхности раздела фаз. Например, при одинаковой степени измельчения поверхность раздела будет постоянной и уравнение скорости гетеро-генной реакции СО2(Г) + С(К) = 2СО(Г) записывается так:
V = k · [СО2].
Влияние температуры. Экспериментально установлено, что в некотором интервале температур скорость реакции при повышении температуры на каждые 10о увеличивается в число раз, равное температурному коэффициенту γ (правило Вант-Гоффа), т. е.
VT2 = VT1 · γ 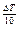 ,
,
где VT2 и VT1 – скорости реакции при температурах Т1 и Т2; Δ T – изменение температуры, равное Т2–Т1; γ – температурный коэффициент реакции, в большинстве случаев имеющий значения от 2 до 4.
Температурный коэффициент γ показывает, во сколько раз изменится скорость реакции при изменении температуры на 10 оС: γ = VT2/VT1 при Δ T = 10.
Влияние температуры на скорость реакции весьма существенно. Химическое взаимодействие происходит при столкновении только тех молекул, энергия которых выше энергии активации (Еакт).
Энергия активации (кДж/моль) – это количество энергии, которое необходимо приложить к 1 молю вещества, чтобы произошло превращение исходных веществ в продукты реакции. Иначе говоря, энергия активации – это разность между наименьшим избыточным запасом энергии, необходимым для взаимодействия молекул, и их среднестатичстическим запасом энергии.
Энергия активации связана с константой скорости реакции уравнением Аррениуса:
K = A · e 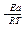 ,
,
где А – предэкспоненциальный множитель, учитывающий строение вещества; R – универсальная газовая постоянная, равная 8, 314 Дж/моль . К; Т – абсолютная температура, К; Еакт – энергия активации процесса, Дж/моль; е – основание натурального логарифма.
Влияние катализатора.Катализаторы – это вещества, которые резко изменяют скорость термодинамически возможной химической реакции, участвуют в ней на промежуточных стадиях, но в конце реакции остаются химически неизменными. Катализ – явление изменения скорости реакции при внесении катализатора. По фазовому состоянию реагентов и катализатора различают гомогенный катализ, при котором они находятся в одной и той же фазе, и гетерогенный катализ, при котором катализатор образует самостоятельную фазу.
По действию различают положительные катализаторы, которые увеличивают скорость реакции, и отрицательные катализаторы, уменьшающие ее.
Положительные катализаторы снижают величину энергии активации процесса. Так, в реакции СН3СНО → СН4 + СО без участия катализатора энергия активации составляет 216, 7 кДж/моль, тогда как в присутствии паров иода (катализатор) Еакт = 143, 0 кДж/моль. Отрицательные катализаторы повышают энергию активации всей реакции.