
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Тема 3. Химическое равновесие
|
|
Рекомендуемая литература: [1], гл. 6, 6.2.8; [2], гл. 5, § 5.5, гл. 6, § 6.1; [5], гл. V.
Химические реакции и физико-химические процессымогут быть необратимыми и обратимыми. Необратимые процессы протекают только в одном направлении и до конца, т.е. до полного расходования хотя бы одного из исходных веществ.
Реакции, которые могут одновременно проходить как в прямом, так и в обратном направлении, называются обратимыми. Обратимые реакции никогда не протекают до конца, т.к. ни одно из реагирующих веществ не расходуется полностью:
аА + вВ ⇄ cC + dD,
где A и B – исходные вещества; C и D – продукты прямой реакции; a, b, c и d – соответствующие стехиометрические коэффициенты.
Состояние химического равновесия устанавливается при равенстве скоростей прямой и обратной реакций: 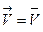 , в соответствии с законом действия масс получаем равенство:
, в соответствии с законом действия масс получаем равенство: 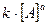 ·
· 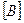
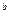 =
= 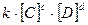 , откуда
, откуда
КР = 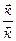 =
= 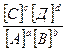
КР – константа равновес ия, выражается через константы скоростей прямой и обратной реакций 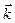
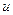
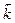 , или через равновесные концентрации реагентов прямой ([A]а·[B]b) и обратной ([C]c·[D]d) реакций. В состоянии равновесия концентрации всех веществ в реакционной системе взаимосвязаны друг с другом, изменение концентрации любого из них вызывает изменение концентрации других. Поэтому соотношение этих концентраций, выражаемое константой равновесия, при данной температуре остается постоянной величиной. Так, для системы: СО2(г) + 4Н2(г) ⇄ СН4(г) + 2Н2О(г) константа равновесия может быть выражена следующим образом:
, или через равновесные концентрации реагентов прямой ([A]а·[B]b) и обратной ([C]c·[D]d) реакций. В состоянии равновесия концентрации всех веществ в реакционной системе взаимосвязаны друг с другом, изменение концентрации любого из них вызывает изменение концентрации других. Поэтому соотношение этих концентраций, выражаемое константой равновесия, при данной температуре остается постоянной величиной. Так, для системы: СО2(г) + 4Н2(г) ⇄ СН4(г) + 2Н2О(г) константа равновесия может быть выражена следующим образом:
КР = 
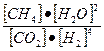


Физический смысл константы равновесия определяется соотношением констант скоростей прямой и обратной реакций 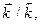 и показывает, во сколько раз скорость прямой реакции больше скорости обратной реакции при одинаковой концентрации всех веществ в системе, равной единице, и данной постоянной температуре. Величина константы равновесия зависит от природы реагирующих веществ и температуры, но не зависит от концентрации и присутствия катализаторов.
и показывает, во сколько раз скорость прямой реакции больше скорости обратной реакции при одинаковой концентрации всех веществ в системе, равной единице, и данной постоянной температуре. Величина константы равновесия зависит от природы реагирующих веществ и температуры, но не зависит от концентрации и присутствия катализаторов.
Смещением или сдвигом равновесия называется процесс изменения равновесных концентраций веществ, вызванный нарушением равновесия. Состояние химического равновесия может существовать сколь угодно долго, но нарушается при изменении концентраций реагирующих веществ и продуктов реакций, температуры и давления (последнее – только для газообразных веществ). Все эти параметры влияют на скорость реакции. Таким образом, чтобы нарушить состояние химического равновесия, необходимо изменить скорости прямой или обратной реакций и тем самым нарушить их равенство.
Для смещения равновесия и, как следствие, управления направленностью обратимого процесса может быть использован принцип подвижного равновесия  (принцип Ле Шателье):
(принцип Ле Шателье):
Изменение одного из условий в равновесной системе (температуры, давления, концентрации) вызывает смещение химического равновесия в направлении того процесса, который противодействует произведенному изменению.
Так, в системе СН4(Г) + СО2(Г) ⇄ 2СО(Г) + 2Н2(Г), Δ Η > 0 равновесие смещается вправо, т.е. в направлении прямой реакции в следующих случаях:
– при повышении температуры, т.к. при этом равновесие должно смещаться в сторону эндотермического процесса;
– при увеличении концентрации метана и (или) оксида углерода (IV) или при уменьшении концентрации оксида углерода (II) и водорода, что вытекает из закона действия масс;
– при понижении давления в системе, поскольку количество газообразных молекул продуктов прямой реакции преобладает над количеством молекул исходных веществ.
В случае реакции, протекающей в растворе, процесс обратим, если хотя бы один реагент и один продукт реакции проявляют свойства слабого электролита. Например, в обратимой реакции гидролиза ацетата калия СН3СООК + Н2О ⇄ СН3СООН + КОН, Δ Η > 0 реагентами – слабыми электролитами являются: в прямой реакции – вода, в обратной реакции нейтрализации – уксусная кислота. При этом равновесие смещено в сторону образования более слабого электролита – воды, т.е. влево. Для смещения равновесия вправо следует увеличить концентрацию воды (разбавить раствор), уменьшить концентрацию КОН (путем добавления кислоты, связывающей образующиеся при гидролизе ионы ОН¯ ), повысить температуру (поскольку реакция гидролиза эндотермична). Изменением давления невозможно сместить равновесие в данной реакции, т.к. в ней не участвуют газообразные вещества.
Тема 4 Гетерогенные химические системы и поверхностные явления в них (спецраздел)
Рекомендуемая литература: [1], гл. 10, §§ 10.1-10.3, 105, 108; [2], гл. 6, §§ 6.5, гл. 8, §8.7; [4], гл. 9, § 1-6.
Гетерогенные химические системы (ГХС) состоят из нескольких фаз.
Фаза – это часть ГХС, однородная по химическому составу и агрегатному состоянию во всех своих точках и отделенная от других частей системы границей раздела (межфазной поверхностью).
Гетерогенные химические системы бывают со сплошными границами раздела фаз (например, жидкость в емкости в контакте с воздухом), а могут быть дисперсными.
Дисперсные ГХС – гетерогенные системы, в которых частицы одной фазы, называемой дисперсной, находятся в раздробленном (диспергированном) состоянии и равномерно распределены между частицами другой фазы, называемой дисперсионной средой (например, сырая нефть, содержащая природные поверхностно-активные вещества, в воде). В отличие от гомогенных дисперсных систем (истинных растворов), размеры частиц дисперсной фазы в гетерогенных дисперсных системах (ГДС) превышают ионно-молекулярный уровень.
Природа веществ, образующих фазы, различна, поэтому на межфазной поверхности (МП) возникают нескомпенсированные молекулярные силы и, как результат, избыточная поверхностная энергия Гиббса:
DGпов = s . S, кДж,
где S (м2) – суммарная площадь поверхности раздела фаз, s (кДж/м2) – удельная поверхностная энергия Гиббса, т.е. приходящаяся на единицу поверхности раздела фаз. Для систем с конденсированными фазами s называют поверхностным натяжением.
Стремление ГХС уменьшить значение DGпов обусловливает возникновение в них поверхностных явлений: смачивание, адгезия, сорбция (адсорбция или абсорбция), а в гетерогенных дисперсных системах еще возникает агрегация и коагуляция.
Смачивание – это межмолекулярное взаимодействие на границе раздела фаз между веществами двух конденсированных фаз, находящихся в контакте с газовой фазой. Полное (растекание) или частичное смачивание поверхности одной фазы веществом другой фазы оказывается возможным только если эти вещества способны к какому-либо межмолекулярному взаимодействию (силы Ван-дер-Ваальса, водородные связи и др.).
Адгезия – это смачивание, завершаемое прилипанием одной фазы к поверхности другой фазы.
Адсорбция – это концентрирование вещества, растворенного в одной фазе (эта фаза представляет собой истинный раствор), на поверхности другой фазы, т.е. на границе раздела фаз. Вещество, которое адсорбируется – адсорбат; вещество, на поверхности которого происходит адсорбция – адсорбент. Процесс адсорбции обратим и достигает состояния равновесия. Обратный процесс – десорбция.
В основе адсорбции лежит тот или иной вид межмолекулярного взаимодействия между адсорбатом и адсорбентом на границе раздела фаз. Существует правило: подобное адсорбируется на подобном, т.е. полярные вещества адсорбируются на полярных адсорбентах и наоборот.
Смачивание и адсорбция приводят к частичной компенсации нескомпенсированных молекулярных сил на границе раздела фаз и в результате – к снижению удельной поверхностной энергии s, а, следовательно, и к уменьшению DGпов.
Особую роль играет адсорбция поверхностно-активных веществ (ПАВ). Молекулы ПАВ дифильны, они в своей структуре имеют неполярный гидрофобный фрагмент и полярный гидрофильный фрагмент. Благодаря такому строению молекулы ПАВ могут адсорбироваться на любой межфазной поверхности: полярной частью на полярной поверхности, а неполярной частью на неполярной поверхности.
В результате адсорбции ПАВ происходит уравнивание полярностей поверхностей фаз на границе их раздела и, как результат – снижение s и DGпов.
Отличительным признаком действия ПАВ является возрастание эффекта снижения поверхностного натяжения (s) по мере увеличения концентрации ПАВ (т.е. степени адсорбции) на границе раздела фаз (до момента достижения равновесия).
Гетерогенные дисперсные системы (ГДС) имеют громадное множество границ раздела между частицами дисперсной фазы и дисперсионной среды. В результате этого суммарная площадь поверхности раздела фаз (S) и, следовательно, DGпов в ГДС очень значительны. Гетерогенные дисперсные системы имеют возможность самопроизвольного уменьшить величину S путем слипания или слияния частиц дисперсной фазы. Такое явление называется агрегацией. В результате укрупнения частиц дисперсной фазы их масса растет, и в какой-то момент происходит их оседание под действием сил тяжести. Такое явление называется седиментацией. Агрегация, приводящая к седиментации и имеющая необратимый характер, называется коагуляцией. В результате коагуляции происходит разрушение ГДС.
Стабилизация ГДС может быть достигнута в результате адсорбции ПАВ или возникновения двойного электрического слоя на границах раздела частиц дисперсной фазы и дисперсионной среды. Возможность действия этих факторов определяется природой частиц фазы и среды.
В зависимости от размера частиц дисперсной фазы ГДС подразделяются на коллоидные растворы (размер частиц фазы 10-7 – 10-5 см) и взвеси (размер частиц фазы более 10-5 см). Взвеси подразделяются на микрогетерогенные системы (размер частиц 10-5 – 10-3 см) и грубодисперсные системы (размер частиц 10-3 – 1 см).
По агрегатному состоянию дисперсной фазы и дисперсионной среды ГДС подразделяются на следующие разновидности (табл. 4.1):
Таблица 4.1 – Разновидности гетерогенных дисперсных систем
| Дисперсионная среда | Дисперсная фаза | Обозначение (фаза/среда) | Название |
| Газообразная (Г) | Жидкая (Ж) Твердая (Т) | Ж/Г Т/Г | Аэрозоли |
| Жидкая (Ж1) | Газообразная (Г) Жидкая (Ж2) Твердая (Т) | Г/Ж1 Ж2/Ж1 Т/Ж1 | Жидкие пены Эмульсии Суспензии |
| Твердая (Т1) | Газообразная (Г) Жидкая (Ж) Твердая (Т2) | Г/Т1 Ж/Т1 Т2/Т1 | Твердые пены, пористые тела Капиллярные системы, твердые эмульсии Сплавы, минералы |