
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Примеры решения задач. Решение. Т.к. количество молей эквивалентов H2SO4 в исходном и приготовленном растворах одинаково, то
|
|
Пример 1. Какой объем 0, 1 н. раствора серной кислоты необходимо отмерить для приготовления 100 мл 0, 02 н. раствора?
Решение. Т.к. количество молей эквивалентов H2SO4 в исходном и приготовленном растворах одинаково, то, в соответствии с законом эквивалентов (7), объем исходного раствора V 1 = 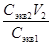 =
= 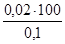 =20 мл.
=20 мл.
Пример 2. Какой объем 12%-ного раствора H2SO4 потребуется для приготовления 1 л 0, 1н. раствора этой кислоты.
Решение. Масса серной кислоты в 1 л 0, 1н. раствора составляет
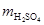 =
= 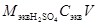 = 49× 0, 1× 1=4, 9 г. Такая масса H2SO4 содержится в 40, 83 г 12%-ного раствора в соответствии с формулой (1):
= 49× 0, 1× 1=4, 9 г. Такая масса H2SO4 содержится в 40, 83 г 12%-ного раствора в соответствии с формулой (1): 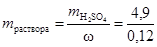 =40, 83 г.
=40, 83 г.
Плотность исходного раствора по данным табл.3 Приложения составляет r =1080, 0 г/л. Следовательно, для приготовления 1 л 0, 1н. раствора H2SO4 потребуется 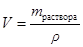 =
= 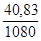 =0, 0378 л или 37, 8 мл 12%-ного раствора.
=0, 0378 л или 37, 8 мл 12%-ного раствора.
Пример 3. Плотность водного раствора NaCl r = 1095, 0 г/л. Определить массовую долю соли в растворе, рассчитать молярную долю NaCl, молярную концентрацию, молярную концентрацию эквивалента соли, моляльную концентрацию и массовую концентрацию раствора.
Решение. Для определения массовой доли соли в растворе используем данные табл.3 Приложения. Заданное значение плотности раствора NaCl в табл.3 отсутствует, поэтому применим метод интерполяции. Для этого используем ближайшие меньшее и большее значения плотностей и соответствующие им массовые доли раствора данной соли. Считая, что в указанных пределах зависимость между плотностью и массовой долей раствора линейная, рассчитаем массовую долю растворенного вещества w в растворе по пропорции (индекс б означает " большее", м - " меньшее"):
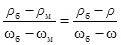 .
.
По данным табл.3 r б=1100, 9 г/л; wб= 0, 14; r м=1085, 7 г/л; wм= 0, 12. Соответственно:
 .
.
Решая уравнение, получим w=0, 132 (или 13, 2%).
При расчете молярной доли соли в растворе и других концентраций удобно использовать следующие соотношения: масса раствора – 100 г, следовательно, масса растворенного вещества т = 13, 2г, а масса воды (растворителя) ms = 86, 8 г = 0, 0868 кг. В таком растворе число молей NaCl составит n NaCl = 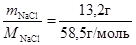 =0, 2256 моль, а число молей воды
=0, 2256 моль, а число молей воды 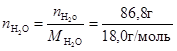 =4, 8222 моль.
=4, 8222 моль.
Следовательно, молярная доля NaCl в соответствии с уравнением (2), 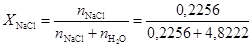 =0, 045.
=0, 045.
По уравнению (3) рассчитаем моляльную концентрацию:
Сm = 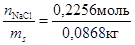 =2, 6 моль/кг.
=2, 6 моль/кг.
Раствор массой 100 г занимает объем V = 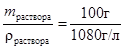 =0, 0926 л, следовательно:
=0, 0926 л, следовательно:
молярная концентрация по уравнению (4): С = 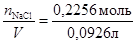 =2, 48моль/л,
=2, 48моль/л,
молярная концентрация эквивалента по (5): С экв= 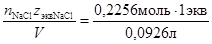 =2, 48 моль экв/л,
=2, 48 моль экв/л,
массовая концентрация по (6): С масс = 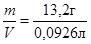 =144, 54 г/л.
=144, 54 г/л.
Для расчетов можно использовать и соотношения табл.1 Приложения:
1) С= 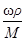 =
= 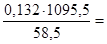 2, 48 моль/л; 2) С экв= Сz экв=2, 48× 1= 2, 48 моль экв/л;
2, 48 моль/л; 2) С экв= Сz экв=2, 48× 1= 2, 48 моль экв/л;
3) Сm= 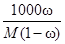 =
= 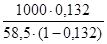 =2, 6моль/кг; 4) С масс = w r =0, 132× 1095 =144, 54 г/л.
=2, 6моль/кг; 4) С масс = w r =0, 132× 1095 =144, 54 г/л.
Контрольные вопросы и задачи для защиты лабораторной работы
1–20. Рассчитать массовую долю, молярную концентрацию, молярную концентрацию эквивалента, моляльную концентрацию и массовую концентрацию раствора данного вещества, используя значение плотности данного раствора и соответствующие величины табл.3.
| № | Раствор NaCl r, г/л | № | Раствор H2SO4 r, г/л | № | Раствор HCl r, г/л | № | Раствор CH3COOH r, г/л |
| 1010, 0 | 1030, 0 | 1015, 0 | 1006, 0 | ||||
| 1050, 0 | 1050, 0 | 1035, 0 | 1010, 0 | ||||
| 1080, 0 | 1090, 0 | 1055, 0 | 1018, 0 | ||||
| 1120, 0 | 1190, 0 | 1080, 0 | 1025, 0 | ||||
| 1170, 0 | 1250, 0 | 1125, 0 | 1032, 0 |
21–35. Рассчитать массу соли и объем воды, необходимые для приготовления 1 л раствора NaCl заданного состава w, используя величины табл.3
| № | w | № | w | № | w |
| 0, 01 | 0, 08 | 0, 18 | |||
| 0, 02 | 0, 10 | 0, 20 | |||
| 0, 03 | 0, 12 | 0, 22 | |||
| 0, 04 | 0, 14 | 0, 24 | |||
| 0, 06 | 0, 16 | 0, 26 |
36–55. Используя данные табл.3, рассчитать объем заданного раствора, необходимый для приготовления 1 л 0, 1н. раствора кислоты H2SO4 или HCl:
| № | Концентрация | № | Концентрация | № | Концентрация | № | Концентрация |
| w=0, 350 | w=0, 227 | w=0, 262 | w=0, 165 | ||||
| w=0, 326 | w=0, 201 | w=0, 243 | w=0, 145 | ||||
| w=0, 302 | w=0, 174 | w=0, 223 | w=0, 125 | ||||
| w=0, 277 | w=0, 147 | w=0, 204 | w=0, 105 | ||||
| w=0, 252 | w=0, 091 | w=0, 184 | w=0, 085 |
Таблица 3.
Плотности водных растворов некоторых веществ при 20оС
| NaCl | H2SO4 | HCl | CH3COOH | ||||
| w | r, г/л | w | r, г/л | w | r, г/л | w | r, г/л |
| 0, 01 | 1005, 3 | 0, 003 | 1000, 0 | 0, 004 | 1000, 0 | 0, 04 | 1004, 1 |
| 0, 02 | 1012, 5 | 0, 032 | 1020, 0 | 0, 024 | 1010, 0 | 0, 08 | 1009, 8 |
| 0, 04 | 1026, 8 | 0, 062 | 1040, 0 | 0, 044 | 1020, 0 | 0, 12 | 1015, 4 |
| 0, 06 | 1041, 3 | 0, 091 | 1060, 0 | 0, 064 | 1030, 0 | 0, 16 | 1020, 8 |
| 0, 08 | 1055, 9 | 0, 120 | 1080, 0 | 0, 085 | 1040, 0 | 0, 20 | 1026, 1 |
| 0, 10 | 1070, 7 | 0, 147 | 1100, 0 | 0, 105 | 1050, 0 | 0, 24 | 1031, 2 |
| 0, 12 | 1085, 7 | 0, 174 | 1120, 0 | 0, 125 | 1060, 0 | 0, 28 | 1036, 0 |
| 0, 14 | 1100, 9 | 0, 201 | 1140, 0 | 0, 145 | 1070, 0 | 0, 32 | 1040, 5 |
| 0, 16 | 1116, 2 | 0, 227 | 1160, 0 | 0, 165 | 1080, 0 | 0, 36 | 1044, 8 |
| 0, 18 | 1131, 9 | 0, 252 | 1180, 0 | 0, 184 | 1090, 0 | 0, 40 | 1048, 8 |
| 0, 20 | 1147, 8 | 0, 277 | 1200, 0 | 0, 204 | 1100, 0 | 0, 44 | 1052, 5 |
| 0, 22 | 1164, 0 | 0, 302 | 1220, 0 | 0, 223 | 1110, 0 | 0, 48 | 1055, 9 |
| 0, 24 | 1180, 4 | 0, 326 | 1240, 0 | 0, 243 | 1120, 0 | 0, 52 | 1059, 0 |
| 0, 26 | 1197, 2 | 0, 350 | 1260, 0 | 0, 262 | 1130, 0 | 0, 56 | 1061, 8 |