
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Практическая часть. Молярную концентрацию эквивалента исходного раствора кислоты (обычно 0,1 н.), а также концентрацию и объем (50 или 100 мл) конечного раствора указывает
|
|
Молярную концентрацию эквивалента исходного раствора кислоты (обычно 0, 1 н.), а также концентрацию и объем (50 или 100 мл) конечного раствора указывает преподаватель. Определение концентрации осуществляется методом титрования стандартным (титрованным) раствором щелочи (NaOH или КОН). Титриметрической реакцией является реакция нейтрализации раствора кислоты раствором щелочи. Конечную точку титрования устанавливают по изменению окраски кислотно-основного индикатора (фенолфталеина или метилового оранжевого).
1. Порядок проведения работы
1. Рассчитайте объем (мл) исходного 0, 1н. раствора серной кислоты, необходимый для приготовления 100 (или 50) мл раствора H2SO4 заданной преподавателем концентрации: 0, 003н.; 0, 004н.; 0, 005н. и т.п. (см. пример 1).
2. Отмерьте необходимый объем исходного раствора кислоты с помощью мерной бюретки. Для этого определите начальный уровень исходного раствора кислоты в бюретке с точностью до 0, 1 мл. (При определении уровня глаз наблюдателя и нижний край мениска жидкости должны находиться на одной горизонтальной плоскости.) Конечный уровень раствора в бюретке равен сумме начального значения и рассчитанного в п.1 объема кислоты.
3. Перенесите рассчитанный объем кислоты в колбу, имеющую метку объема 100 (или 50) мл. Для этого осторожно поверните кран бюретки или надавите на стеклянный шарик в резиновой трубочке.
4. Приливая дистиллированную воду, доведите объем раствора в колбе до 100 (или 50) мл.
5. Добавьте 2-3 капли индикатора фенолфталеина. Отметьте окраску раствора.
6. Определите уровень титранта (0, 1н. раствора NaOH или КОН) в бюретке с точностью до 0, 1 мл. Запишите начальный уровень титранта h н.
7. Проводите титрование раствора кислоты, добавляя небольшими порциями раствор щелочи в колбу с кислотой. Раствор кислоты при этом непрерывно перемешивайте, держа горло колбы правой рукой. Кран (или зажим) бюретки открывайте левой рукой.
8. Конец титрования определите по появлению едва заметной, не исчезающей в течение 30 с, малиновой окраски фенолфталеина. (Окраску раствора удобнее наблюдать на белом фоне, поэтому подложите под колбу листок белой бумаги.) Отметьте и запишите конечный уровень титранта в бюретке h к.
9. Добавьте еще одну каплю раствора щелочи. Если окраска раствора стала более заметной, значит, конечная точка титрования определена правильно.
10. Повторите действия п.п.2-9, заменив фенолфталеин другим индикатором – метиловым оранжевым. Конец титрования определите по соответствующему изменению окраски индикатора (см. табл.2).
2.Обработка результатов
1. По разности конечного h к и начального h н уровней жидкости в бюретке рассчитайте объем титранта V щ, израсходованного на титрование в присутствии индикатора фенолфталеина.
2. Рассчитайте молярную концентрацию эквивалента приготовленного раствора кислоты С экв к по формуле: С экв к = 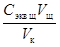 , где V к = 100 (или 50) мл,
, где V к = 100 (или 50) мл, 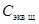 =0, 1 моль экв/л.
=0, 1 моль экв/л.
3. Сравните заданное значение концентрации раствора кислоты С экв, к, з и определенное методом титрования значение концентрации приготовленного раствора Сэкв, к и рассчитайте суммарную погрешность титрования и приготовления раствора по формуле:
h=½ 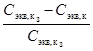 ½ 100%.
½ 100%.
4. Проведите расчет концентрации раствора кислоты при титровании с другим индикатором (метиловым оранжевым), повторив п.п.1- 3.
5. Напишите уравнение титриметрической реакции в молекулярной форме. Исходные данные, результаты измерений и расчетов занесите в таблицу.
Таблица
| Индикатор | V к, мл | С экв к, з, моль экв/л | С экв щ, моль экв/л | h н, мл | h к мл | V щ, мл | С экв, к, моль экв/л | h |
| фенолфталеин | ||||||||
| Метил-оранжевый | 0, 1 |
6. Объясните, чем вызваны расхождения в величинах концентрации одного и того раствора, оттитрованного в присутствии разных индикаторов. При каких значениях рН раствора происходит изменение окраски использованных индикаторов? Какова относительная систематическая погрешность h с титрования заданного раствора в каждом случае?