
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Примеры расчета эквивалентов веществ.
|
|
1. Рассчитать эквивалент железа в реакциях:
а) Fe + H2SO4 (разб.) = FeSO4 + H2;
б) 2Fe +6H2SO4 (конц.) = Fe2(SO4)3 +3 SO2 + 6H2O.
Для реакции (а) Fe – 2e = Fe+2 и эквивалентное число Z =2. Эквивалент железа равен Э = ½ ФЕ, молярная масса эквивалента железа равна
М экв = ½ М = 55, 85: 2 = 27, 925 г/моль.
Для реакции (б) Fe – 3e = Fe+3 и эквивалентное число Z =3. Эквивалент железа равен Э = ⅓ ФЕ, молярная масса эквивалента железа равна
М экв = ⅓ М = 55, 85: 3 = 18, 617 г/моль.
2. Вычисление эквивалентного числа для кислот, оснований и солей в реакциях обмена.
Для кислоты эквивалентное число определяется количеством ионов водорода, замещающихся ионами металла, т.е. основностью кислоты:
а) H3PO4 + NaOH = NaH2PO4 + H2O, Z (H3PO4) =1
б) H3PO4 + 2 NaOH = Na2HPO4 + 2H2O, Z (H3PO4) =2
в) H3PO4 + 3 NaOH = Na3PO4 + 3H2O, Z (H3PO4) =3
Для основания эквивалентное число определяется количеством ионов гидроксида, замещающихся анионами кислоты, т.е. кислотностью основания:
а) Al(OH)3 + HCl = Al(OH)2Cl + H2O, Z [Al(OH)3] = 1
б) Al(OH)3 + 2HCl = Al(OH)Cl2 + 2H2O, Z [Al(OH)3] = 2
в) Al(OH)3 + 3HCl = Al(OH)3 + 3H2O, Z [Al(OH)3] = 3
Для соли эквивалентное число определяется произведением валентности (степени окисления) катиона (или аниона по модулю) n на количество катионов (или анионов) m: Z = n·m
а) NaCl, Z =1·1=1; б) Na2SO4, Z = 1·2=2; в) Al2(SO4)3, Z =3·2=6;
г) Na[HSO4], Z =1·1=1; д) [Al(OH)]Cl2, Z =2·1=2;
e) [Cu(NH3)4](OH)2, Z =2·1=2.
3. Вычисление эквивалентного числа окислителя и восстановителя в окислительно-восстановительной реакции.
Эквивалентное число окислителя и восстановителя в окислительно-восстановительной реакции определяется количеством принятых или отданных электронов.
3 H2S + K2Cr2O7 + 4 H2SO4 = Cr2(SO4)3 + 3 S + K2SO4 + 7 H2O
восстановитель: H2S – 2e = S + 2H+, Z = 2, М экв = 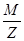 =
=  =17 г/моль;
=17 г/моль;
окислитель: Cr2O72- + 14 H+ + 6e = 2 Cr3+ + 7 H2O, Z = 6,
М экв = 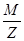 =
= 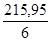 = 35, 99 ≈ 36 г/моль
= 35, 99 ≈ 36 г/моль
Экспериментально эквивалент элемента может быть определен химическим путем - определением количества присоединяемого или замещаемого элементом водорода, кислорода или другого элемента, эквивалент которого известен, или электрохимическим путем на основании закона Фарадея, согласно которому при прохождении 96494 Кл электричества через раствор электролита на электродах превращается один эквивалент вещества.
В данной работе использован наиболее простой и доступный способ определения эквивалента активного металла, основанный на измерении объема водорода при реакции вытеснения его из раствора соляной кислоты:
Me + n HCl = MeCln +  H2
H2
Согласно закону эквивалентов, один эквивалент металла вытесняет один эквивалент водорода, имеющий молярную массу эквивалента 1 г/моль.
Используя закон Авогадро, можно определить объем, который занимает один эквивалент водорода при определенных физических условиях. При нормальных физических условиях (р = 1, 013·105 Па или р =760 мм рт. ст., Т = 298 К) 1 моль водорода, имеющий массу 2 г/моль, занимает объем
V = 22, 4 л, тогда 1 моль эквивалента водорода, имеющий массу 1 г/моль, должен занимать объем V экв = 11, 2 л. Таким способом можно рассчитать эквивалентный объем любого газа при нормальных условиях.
Вопросы для предварительной подготовки лабораторной работы
1. Что называют эквивалентом вещества? Как определяется эквивалентное число и фактор эквивалентности?
2. Определите эквивалентное число и фактор эквивалентности для веществ:
а) Fe2O3, б) HClO4, в) NaHS, г) MgOHCl, д) Ca(OH)2.
3. Как связаны молярная масса вещества и молярная масса эквивалента? Рассчитайте молярную массу эквивалента веществ, приведенных в вопросе 1.
4. Как рассчитывается молярная масса эквивалента окислителя и восстановителя в окислительно-восстановительной реакции?
5. Рассчитайте молярную массу эквивалента перманганата калия KMnO4, рассматривая данное соединение как:
а) соль; б) окислитель, превращающийся в MnO(OH)2;
в) окислитель, превращающийся в MnSO4.
6. Какой объем занимает при нормальных условиях 1 моль эквивалента
газообразного вещества: а) кислорода, б) хлора; в) углекислого газа?
7. Используя закон эквивалентов, рассчитайте объем оксида
углерода (II), который потребуется для восстановления железа из 1 кг
оксида железа (III) при нормальных условиях.