
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Номенклатура
|
|
Получение
1.Декарбоксилирование натриевых солей карбоновых кислот. В лаборатории метан получают при нагревании ацетата натрия CH3COONa с твердым гидроксидом натрия:
CH3COONa+NaOH –-- CH4 +Na2CO3
2.Синтез Вюрца. Этан и другие предельные углеводороды с более длинной цепью можно получить при взаимодействии однородных галогенпроизводных предельных углеводородов с металлическим натрием:
CH3 - I Na
+ –--CH3 – CH3 +2Na I
CH3- I Na
йодметан этан
Первым эту реакцию в 1855 году осуществил французский химик А.Вюрц (реакция Вюрца)
Простейший представитель предельных углеводородов – метан – образуется в природе в результате разложения остатков растительных и животных организмов без доступа воздуха.Он содержится и в газах, выделяющихся при добыче нефти. В состав природного газа и нефтяных газов входят также этан C2H6, пропан C3H6, бутан C4H6 и некоторые другие. Газообразные, жидкие и твердые предельные углеводороды содержаться в нефти
ФС
Метан – газ без цвета и запаха, почти в 2 раза легче воздуха, мало растворим в воде. Этан, пропан, бутан при нормальных условиях – газы, от пентана до пентадекана – жидкости, а следующие гомологи – твердые вещества (таблица 1). Пропан и бутан под давлением могут находиться в жидком состоянии и при обыкновенной температуре.
ХС
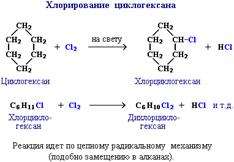
1.Наиболее характерными реакциями предельных углеводородов являются реакции замещения. Так, например, при освещении метан реагирует с хлором (при сильном освещении может произойти взрыв):
H H
| t |
H – C – H + Cl –Cl ----H – C –Cl + HCl
| |
H H
2.Все предельные углеводороды горят с образованием оксида углерода (IV) и воды. Метан горит бесцветным пламенем, с выделением теплоты:
CH4+2O2=CO2+H2O+880 кДж
Вопрос 2, 3. конец
Смесь метана с кислородом (в объемном отношении 1: 2) или с воздухом (1: 10) при поджигании сгорает со взрывом. Взрыв может происходить и при др.соотношениях смеси с воздухом.
3.При сильном нагревании(выше 1000 градусов) без доступа воздуха предельные углеводороды разлагаются:
CH4 ----C+2H2
Если метан нагреть до более высокой температуры (1500 градусов), то реакция происходит так:
2CH4 ---- C2H2 +3H2
ацетилен
4.Углеводороды нормального строения под влиянием катализаторов и при нагревании подвергаются реакциям изомеризации и превращаются в углеводороды разветвленного строения:
CH3- CH2- CH2- CH2- CH3 ---- CH3 - CH- CH2- CH3
|
CH3 хлорметан
Вопрос 4.
Циклоалканы относят к карбоциклическим углеводородам – вещества, молекулы которых содержат замкнутую цепь атомов углерода (цикл).
Номенклатура
Циклоалканы – это циклические углеводороды, не содержащие в молекуле кратных связей и соответствующие общей формуле: 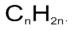
Точно такой же формулой описывается гомологический ряд алкенов. Из чего следует, что каждому циклоалкану изомерен соответствующий алкен. Это пример так называемой межклассовой изомерией.
Изомерия
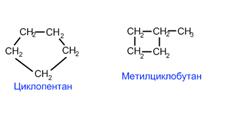
Для циклоалканов как и для всех классов органических соединений, характерна изомерия углеродного скелета (1. Структурная изомерия). Для циклоалканов характерно структурная изомерия связанная с размером цикла,
со взаимным расположением заместителей в кольце,
со строением заместителя
Структурная изомерия для циклоалканов, во-первых, обусловлена размером цикла. Так, существует два циклоалкана формулы С4Н8: циклобутан и метилциклопропан. Во-вторых, такая изомерия обусловливается положением заместителей в цикле (например, 1, 1 и 1, 2-диметилбутан).
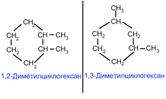
Изомерия положения заместителей в кольце
Вопрос 4. продолжение
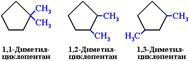
3. Межклассовая изомерия с алкенами:

Отсутствие свободного вращения вокруг связей С-С в цикле создает предпосылки для существования пространственных изомеров у некоторых замещенных циклоалканов. Например, в молекуле 1, 2-диметилциклопропана две группы СН3 могут находиться по одну сторону от плоскости цикла (цисизомер) или по разные стороны (трансизомер):
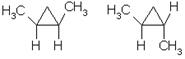
цисизомер трансизомер
По размеру цикла циклоалканы делятся на ряд групп, из которых мы рассмотрим малые (С3, С4) и обычные (С5-С7) циклы.
2. Цис-транс-изомерия, обусловленная различным взаимным расположением в пространстве заместителей относительно плоскости цикла. В цисизомерах заместители находятся по одну сторону от плоскости кольца, в трансизомерах – по разные:
3. Оптическая изомерия некоторых ди- (и более) замещенных циклов. Например, транс-1, 2-диметилциклопропан может существовать в виде двух оптических изомеров, относящихся друг к другу как предмет и его зеркальное изображение.
4. Поворотная изомерия циклоалканов. Все циклы, кроме циклопропана, имеют неплоское строение, что обусловлено стремлением атомов углерода к образованию нормальных (тетраэдрических) углов между связями. Это достигается поворотами по у-связям С–С, входящим в цикл. При этом возникают различные конформации (поворотные изомеры) с разной энергией и чаще реализуются те из них, которые обладают наименьшей энергией, т.е. более устойчивые. Например, в циклогексане наиболее устойчивой является конформация " кресла".
В этой пространственной форме отсутствует угловое напряжение, т.к. все валентные углы имеют нормальные для sp3-гибридизованных атомов значения 109°28’. Кроме того, каждая пара соседних атомов углерода (фрагмент этана) находится в заторможенной конформации.
Физические свойства циклоалканов закономерно изменяются с ростом их молекулярной массы. Пpи ноpмальных условиях циклопpопан и циклобутан – газы, циклоалканы С5 – С16 – жидкости, начиная с С17, – твердые вещества. Температуры кипения циклоалканов выше, чем у соответвующих алканов. Это связано с более плотной упаковкой и более сильными межмолекулярными взаимодействиями циклических структур.
Химические свойства
Вопрос 4. продолжение
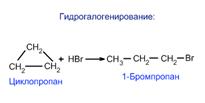
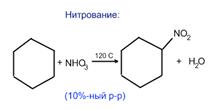
получение циклоалканов:
1. При переработке нефти выделяют главным образом циклоалканы С5 - С7.
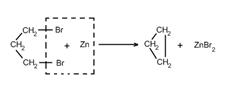
2. Действие активных металлов на дигалогензамещенные алканы (реакция Вюрца) приводит к образованию различных циклоалканов:
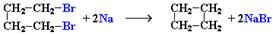
(вместо металлического натрия используется также порошкообразный цинк).
Строение образующегося циклоалкана определяется структурой исходного дигалогеналкана. Этим путем можно получать циклоалканы заданного строения. Например, для синтеза 1, 3-диметилциклопентана следует использовать 1, 5-дигалоген-2, 4-диметилпентан:
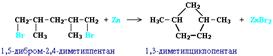
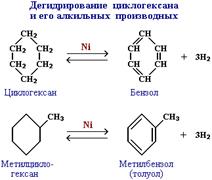
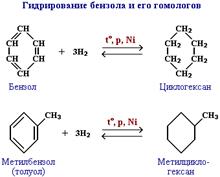
Существуют и другие методы получения циклоалканов. Так, например, циклогексан и его алкильные производные получают гидрированием бензола и его гомологов, являющихся продуктами нефтепереработки.
Вопрос 4. конец
Дегалогенирование дигалогенопроизводных. Трех- и четырехчленные циклы получают децствием цинка на соответствующие дигалогенопроизводные:
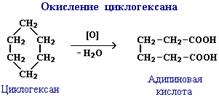
Либо можно получить пиролизом солей дикарбоновых кислот. Циклопентан и циклогексан образуются при пиролизе (нагревании без доступа воздуха) кальциевых солей соответственно гександикарбоновой и гептандикарбоновой кислот и воставлении образующихся кетонов.
Вопрос 6, 7.
Алкены
Углеводороды ряда этилена по международной номенклатуре называют алкенами.
C2H4
Изомерия и номенклатура.
Формулы углеводородов ряда этилена можно вывести из соответствующих формул предельных углеводородов. Названия углеводородов ряда этилена образуют путем изменения суффикса -ан соответствующего предельного углеводорода на -ен или -илен.
Гомологический ряд этилена
C2H4 - Этилен (Этен)
C3H6 - Пропилен (Пропен)
C4H8 - Бутен
C5H10 - Пентен
C6H12 - Гексен
C7H14 - Гептен
C8H16 - Октен
C9H18 - Нонен
C10H20 - Децен
Получение
· Этилен в лаборатории получают при нагревании смеси этилового спирта с концентрированной серной кислотой.
· Углеводороды ряда этилена можно получить также дегидрированием предельных углеводородов.
· На производстве этилен получают из природного газа и при процессах пиролиза нефти.
· Углеводороды ряда этилена можно получить при взаимодействии дигалогенопроизводных предельных углеводородов с металлами.
· При действии спиртовых растворов щелочей на галогенопроизводные отщепляется галогеноводород и образуется углеводород с двойной связью.
Физические свойства
Этилен — бесцветный газ, почти без запаха, немного легче воздуха, плохо растворим в воде. Пропилен и бутены (бутелены) при нормальных условиях также газообразны, от пентена C5H10 до
Вопрос
Вопрос 6, 7. конец
октадецена C18H36 включительно углеводороды находятся в жидком состоянии, а начиная с нонадецена C19H38 - в твердом.
Химические свойства
Химические свойства этилена и его гомологов в основном определяются наличием в их молекулах двойной связи. Для них характерны реакции присоединения, окисления и полимеризации.
· Реакции присоединения.
· Этилен и его гомологи взаимодействуют с галогенами. Так, например, они обесцвечивают бромную воду:
H2C = CH2 + Br2 -> Ch2Br - CH2Br
· Аналогично происходит присоединение водорода (гидрирование этилена и его гомологов)
· В присутствии серной или ортофосфорной кислоты и других катализаторов этилен присоединяет воду (реакция гидратации). Этой реакцией пользуются для получения этилового спирта в промышленности.
· Этилен и его гомологи присоединяют также галогеноводороды. Пропилен и последующие углеводороды ряда этилена реагируют с галогеноводородами согласно правилу В.В.Марковникова.
Водород присоединяется к наиболее, а атом галогена - к наименее гидрированному атому углерода:
(пропилен) CH2 = CH - CH3 + HBr → CH3 - CHBr - CH3 (2 - бромпропан)
· Реакции окисления.
· Этилен и его гомологи способны гореть на воздухе. С воздухом этилен и его газообразные гомологи образуют взрывчатые смеси.
· Этилен и его гомологи легко окисляются, например кислородом перманганатакалия; при этом раствор последнего обесцвечивается.
· Большое промышленное значение имеет частичное окисление этилена кислородом воздуха.
· Реакции полимеризации.
При повышенной температуре, давлении и в присутствии катализаторов молекулы этилена соединяются друг с другом вследствие развала двойной связи.
Процесс соединения многих одинаковых молекул в более крупные называется реакцией полимеризации.
Получение.
Этилен и его соединения используются для получения горючего с высоким октановым числом, пластмасс, взрывчатых веществ, антифризов, растворителей, для ускорения созревания фруктов, для получения ацетальдегида, синтетического каучука.
Вопрос №8, 9.
Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные) углеводороды, содержащие в молекуле одну тройную связь и имеющие общую формулу CnH2n-2.
Изомерия
Алкинам свойственна изомерия углеродного скелета (начиная с C5H8), изомерия положения тройной связи (начиная с C4H6) и межклассовая изомерия с алкадиенами.
Получение
1) В промышленном масштабе для технических целей ацетилен получают высокотемпературным пиролизом метана.
2CH4 ––1500°C® HCєCH + 3H2
2) Алкины можно получить из дигалогенопроизводных парафинов отщеплением галогеноводорода при действии спиртового раствора щелочи. Атомы галогена при этом могут быть расположены как у соседних атомов углерода, так и у одного углеродного атома.
| Вопрос 8, 9 продолжение. СH3–CH–CH2 + 2 KOH ––этанол® CH3–CєCH + 2KBr + 2H2O I I Br Br |
| Br I CH3–C–CH2–CH3 + 2KOH ––этанол® CH3–CєC–CH3(бутин-2) + 2KBr + 2H2O I Br |
3) Ацетилен получают также из ацетиленида (карбида) кальция при разложении его водой.
CaC2 + 2H2O ® Ca(OH)2 + HCєCH