
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Свойства аминов
|
|
При обычной температуре только низшие жирные амины CH3NH2, (CH3)2NH, (CH3)3N – газы (с запахом аммиака), средние амины – жидкости с резким
Вопрос 21 конец.
запахом гниющей рыбы, высшие – твердые вещества без запаха.
Амины, являясь производными аммиака, имеют сходное с ним строение и проявляют подобные ему свойства.
Взаимодействие с водой. Водные растворы алифатических аминов проявляют щелочную реакцию, так как при их взаимодействии с водой образуются гидроксиды алкиламмония, аналогичные гидроксиду аммония:
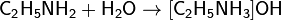
Взаимодействуя с кислотами, амины образуют алкиламмониевые соли, в большинстве
случаев растворимые в воде. Например, амины присоединяют галогеноводороды:
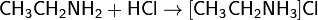
Амины присоединяют галогеналканы RCl, с образованием донорно-акцепторной связи N-R, которая также эквивалентна уже имеющимся.
Ароматические амины реагируют с галогенами по механизму электрофильного замещения в бензольном ядре. При галогенировании анилина бромной водой при комнатной температуре образуется триброманилин (в виде осадка белого цвета):
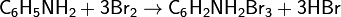
Получение.
Восстановление нитросоединений — Реакция Зинина. Эту реакцию впервые осуществил Н. Н. Зинин в 1842 году. Действуя на нитробензол сульфидом аммония, он получил анилин:
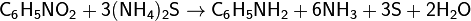
Восстановление железом:
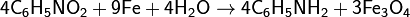
Восстановление водородом в присутствии катализатора и при высокой температуре:
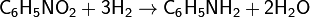
Также возможно получение путем восстановления нитрилов, оксимов, амидов, путем алкилирования аммиака (реакция Гофмана), путем перегруппировки бензильных четвертичных аммониевых солей (реакция Соммле-Хаузера), путем перегруппировки гидроксамовых кислот (перегруппировка Лоссена). Получение аминов
1.Нагревание галогеналканов с аммиаком:
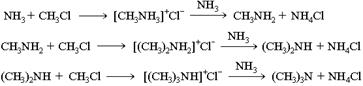
2.Первичные амины получают восстановлением нитросоединений:

Важнейший ароматический амин-анилин- образуется при восстановлении нитробензола:
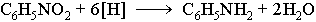
Вопрос 23 конец.
ПРИМЕНЕНИЕ АМИНОКИСЛОТ
Наибольший интерес представляют 20 L-α -аминокислот (аланин, аргинин, аспарагин и другие), входящих в состав белковых молекул. Смеси L-аминокислот, а также индивидуальные аминокислоты (например, метионин) применяют в медицине для парэнтерального питания больных с заболеваниями пищеварительных и других органов, при нарушениях обмена веществ и др.; лизин, метионин, треонин, триптофан - в животноводстве для обогащения кормов; глутамат натрия и лизин - в пищевой промышленности. ω -аминокислоты и их лактамы служат для промышленного производства полиамидов. γ -аминомасляная кислота (аминалон) - медиатор в центральной нервной системе, применяется как лекарственное средствово при сосудистых заболеваниях головного мозга. Ароматические аминокислоты используют в синтезе красителей и лекарственных средств. На основе аминокарбоновых и аминофосфоновых кислот синтезируют селективные комплексоны, комплексообразующие иониты, лигандообменные сорбенты, ПАВ.
Вопрос№22.
Анилин С6H5NH2 – важнейший из ароматических аминов. Он находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств.Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом, т.кип. 184 С, т.пл. -6 С. Ядовит.
1. Анилин - гораздо более слабое основание, чем алифатические амины (Kb = 5, 2.10-10). Это объясняется тем, что электронная пара атома азота, которая обусловливает основные свойства аминов, частично смещается в бензольное кольцо.
Анилин реагирует с сильными кислотами, образуя соли фениламмония C6H5NH3+, которые хорошо растворимы в воде, но нерастворимы в неполярных органических растворителях:
С6Н5NН2 + HCl → С6Н5NН3Сl.
2. Анилин весьма активен в реакциях электрофильного замещения в бензольном кольце. Это объясняется электронными эффектами, которые приводят к увеличению электронной плотности в кольце.
Анилин легко бромируется даже под действием бромной воды, давая белый осадок 2, 4, 6-триброманилина:
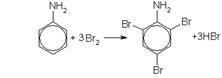
2, 4, 6-триброманилин
3. При реакции анилина с азотистой кислотой образуются диазосоединения — соли диазония C6H5N2+:
C6H5NH2 + NaNO2 + 2HCl → [C6H5-N≡ N]+Cl- + NaCl + 2H2O.
Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении.
Применение. Основная область применения анилина — синтез красителей и лекарственных средств. В качестве примера приведем схему синтеза красителя метилового оранжевого (кислотно-основного индикатора):
Анилин служит исходным веществом для получения ряда лекарственных средств (например, фенацетина и парацетамола) и при изготовлении красок.
Вопрос№23.