
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Синдроми, які обтяжують перебіг цирозів печінки.
|
|
Значно обтяжують перебіг ЦП такі синдроми, як портальна гіпертензія, асцит і портосистемна енцефалопатія.
Портальна гіпертензія. Крізь ворітну вену в печінку поступає основна маса крові з органів черевної порожнини. Це складає понад 75% всієї крові, яка поступає у печінку. Решту 25% крові печінка отримує крізь печінкову артерію. В організмі людини існують природні порто-кавальні анастомози в зонах прямокишкових і гастро-кардіо-езофагеальних венозних сплетень. Через порто-пульмональний анастомоз Калабрезі-Абельмана частина портальної крові може “скидатись” в мале коло кровообігу (в нормі не функціонує).
Відтак існують також природні портокавальні анастомози, анастомози в системі навколопупкових вен, які анастомозують з венами черевної стінки і діафрагми.
Ще 3 групи анастомозів розташовані в заочеревинній клітковині: а) анастомози між венами брижі і венами нирок; б) анастомози між верхньою мезентеріальною і селезінковою венами, а через них із напівнепарною веною; в) анастомози між селезінковою і лівою нирковою венами.
Треба пам’ятати, що 3/4 печінкових капілярів знаходяться в недіяльному стані, складаючи резерв внутрішньопечінкового кровотоку.
З печінки кров відпливає по печінкових венах, які впадають в піддіафрагмальний відділ нижньої порожнистої вени. Всередині печінки між печінковою і ворітною веною існують порто-кавальні анастомози.
В основі портальної гіпертензії лежить перешкода течії крові по системі ворітної вени. Зазвичай цей блок є механічного характеру, проте є випадки й функціональної (спастичної) блокади портального кровотоку.
Розрізняють: 1) внутрішньопечінковий, найбільш частий тип механічної блокади портальної системи; 2) допечінковий; 3) надпечінковий; 4) змішаний тип блокади (при цьому є тромбоз ворітної вени або її гілок).
В розвитку портальної гіпертензії внутрішньопечінкового походження найбільше значення мають цироз печінки, новоутвори всередині печінки, вроджені звуження русла ворітної вени, аномалії внутрішньопечінкового розгалуження ворітної вени.
Допечінкову форму портальної гіпертензії спричиняють вроджені аномалії стовбура ворітної вени, кавернозна його трансформація, вроджена облітерація або стеноз ворітної вени, її тромбоз, стиснення ворітної вени пухлиною, шрамами, інфільтратами, лімфатичними вузлами, первинним або вторинним ворітним цитосклерозом, внаслідок інфекції або травми живота, селезінковою або печінковою артеріо-венозною норицею. Часто причину допечінкового блоку встановити важко.
В розвитку синдрому надпечінкової портальної гіпертензії найбільше значення мають тромбоз печінкових вен (синдром Budd-Chiari), стиснення печінкових вен або стовбура нижньої порожнистої вени шрамом, пухлиною, правошлуночкова серцева недостатність, констриктивний перикардит.
Патогенез портальної гіпертензії неоднаковий у всіх випадках.
Найбільше значення має вузлова регенерація печінки, при якій дезорганізується структура печінкової часточки, стискуються розгалуження ворітної вени. Тиск у венах всередині печінки сягає 600 мм.вод.ст. і більше. З’ясовано, що дрібні вузли регенерації викликають більш обширне стиснення і тому сприяють значному підвищенню портального тиску.
Разом з тим, вузлова регенерація обумовлює розлад васкуляризації печінки, що призводить до погіршення артеріалізації, оксигенації і харчування печінкових клітин, дуже чутливих до кисневого голодування і до підвищення тиску в синусоїдах. Як лише наступає стиснення вузлами регенерації відгалужень печінкових вен, вступає в силу новий фактор: кров з печінкової артерії проникає в розгалуження ворітної вени через перисинусоїдальні артеріо-венозні анастомози, завдяки чому тиск з печінкової артерії передається на систему ворітної вени. Внаслідок цього тиск в синусоїдах ще більш підвищується і портальна гіпертензія зростає.
Окрім вузлової регенерації на внутрішньопечінковий кровобіг великий вплив має і дезорганізація внутрішньочасточкової структури. Внаслідок некрозів у центрі часточок відбувається розлад внутрішньодолькового кровопостачання. Цьому сприяє розвиток фіброзу, клітинна інфільтрація, проліферація купферівських клітин.
Затруднює кровобіг по ворітній вені застійно збільшена селезінка. Виникає спленомегалія з явищами гіперспленізму (анемія, лейко-, тромбоцитопенія). В подальшому приєднується запалення, яке викликає периспленіт, зрощення селезінки з діафрагмою і заочеревинною клітковиною, що частково компенсує портальну гіпертензію шляхом посилення порто-кавального відтоку. Проте, з іншого боку, при цьому ущільнується гіперплазована тканина селезінки, виникає її фіброаденія.
Портальна гіпертензія викликає розвиток колатералів, як природніх, так і нових порто-кавальних, зокрема через вінцеву вену шлунка до венозного сплетення стравоходу і далі через непарну і напівнепарну вени з системою верхньої порожнистої вени. При цьому розширяються вени кардіального відділу шлунка і стравоходу (варикоз вен може досягти рівня дуги аорти і вище). Варикозне поширення вен стравоходу і шлунка може бути джерелом дифузних стравохідно-шлункових кровотеч із смертельним кінцем. В розвитку варикозного розширення вен стравоходу крім механічного чинника, має значення регургітація шлункового вмісту у стравохід з розвитком ерозивного і виразкового езофагіту.
При внутрішньопечінковій формі портальної гіпертензії внаслідок порушення функції печінки спотворюються процеси згортання крові. З одного боку, виникає кровоточивість, а з іншого – гострі тромбози ворітної вени та її головних гілок. Внаслідок анемії і гіпоксії спалахують нові вогнища некрозу, рецидиви кровотеч, печінково-клітинної недостатності з виходом в кому, від якої хворі й помирають.
У розвитку порто-кавальних анастомозів при портальній гіпертензії приймають участь vv.epigastricaе (caput meduse з синдромом Cruveillier-Baumgarten), а також гемороїдальні вени. Кровотеча з останніх може знижувати рівень портальної гіпертензії. Хірургічне видалення такого кровоточивого гемороя небезпечне в плані посилення портальної гіпертензії. В розвитку асциту при внутрішньопечінковій формі портальної гіпертензії, крім механічного фактора, велике значення має гіпопротеїнемія, порушення альдостерону, кортикостероїдів.
На відміну від патогенезу внутрішньопечінкової форми допечінкова форма портальної гіпертензії більш проста. Частіше вслід за закриттям просвіту (тромб, тромбофлебіт, флебосклероз) ворітньої вени або ж її проток виникає гіпертензія в портальній системі, потім з’являються зміни в селезінці, гіпертензивне варикозне розширення вен, розлади гемопоезу. Асциту при цьому не буває.
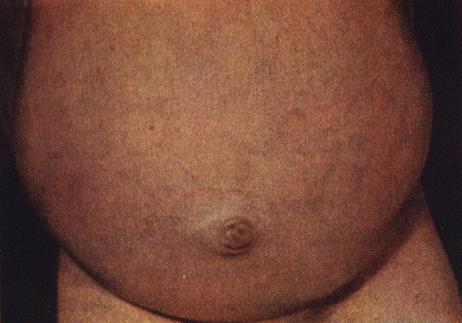 |
Рис. Асцит, набряклі підшкірні вени живота (" голова медузи"), вип'ячений пупок при цирозі печінки (адаптовано за Р.Хеггліним, 1965).
Надпечінкова портальна гіпертензія частіше є наслідком загальних розладів кровообігу при синдромі Budd-Chiari, декомпенсованих вадах серця, констриктивному перикардиті.
Методи дослідження хворих для виявлення портальної гіпертензії:
1. Рентгенівське дослідження стравоходу і кардії з метою виявлення варикозно змінених вен; цей метод дає можливість верифікувати наявність варикозу у 16-18% хворих.
2. Езофагоскопія – дає можливість виявити варикозне розширення вен стравоходу у 69% хворих. Відсоток позитивних результатів збільшується, якщо при езофагоскопії хворому надати положення Тренделенбурга.
3. Ректороманоскопія – дозволяє виявити верикозне розширення вен, діаметр яких досягає 4-6 мм.
4. Портогепатоманометрія проводиться шляхом пункції печінки в IХ-Х міжребер’ях по середньоаксілярній лінії справа.
5. Спленоманометрія. Пункція селезінки проводиться в ІХ-Х міжребер’ях по середній або задній аксілярних лініях зліва. Пункційну голку з’єднують з манометром, в нормі внутрішньоселезінковий тиск 120-180 мм вод.ст. Підвищення тиску понад 200 мм вод.ст. вказує на порушення портального кровобігу. У хворих на внутрішньопечінковий блок рівень внутрішньоселезінкового тиску є вірогідним критерієм тиску у системі ворітної вени.
6. Спленопортографія – рентгенівське дослідження портального кровобігу. З цією метою через пункційну голку в селезінку вводять 20-40 мл рентгенконтрасної речовини (уротраст, кардіотраст, діодон). Проводяться серійні знімки (через 1, 3, 5, 7, 9 і 11 сек.). При цьому вдається константувати прохідність спленопортального русла, розгалужень ворітної вени в печінці, наявність рефлюксів тощо.
7. Лапароскопія з пункційною біопсією допомагає визначити ступінь ураження печінки, наявність розширених вен сальника, шлунка, візуальних морфологічних змін печінки.
Головною клінічною ознакою надпечінкової портальної гіпертензії є спленомегалія без асциту і кровотеч з розширених вен стравоходу. Частіше спленомегалія супроводжується гіперспленізмом. Дуже рідкою є тріада: гіперспленізм, кровотечі, асцит. Печінка зазвичай не пальпується, caput medusaе відсутня.
Розвиток такої портальної гіпертензії здійснюється повільно. У разі появи кровотечі перебіг погіршується – з’являються асцит і печінково-клітинна недостатність.
Найбільш яскравими ознаками внутрішньопечінкової портальної гіпертензії є спленомегалія, варикозне поширення вен з можливими кровотечами, асцит. До ранніх ознак відносять: вперті диспепсичні явища, особливо після їди; здуття живота після прийому будь-якої їжі; відчуття постійного переповнення кишок без виражених закрепів; прогресуюче схуднення і гіповітаміноз при збереженому апетиті і фактично достатньому отриманню калорійного харчування з достатньою кількістю вітамінів; періодично безбольові і безтемпературні проноси. Хворі скаржаться на втомлюваність, зниження працездатності, періодичний біль у надчерев’ї, кровотечі з носа, ясен, а згодом можливі гастроезофагеальні кровотечі.
Чоловіки хворіють частіше, ніж жінки. Розміри печінки різні: від незмінених до різко збільшених. Печінка нерівномірно горбиста. Деколи печінка дуже зменшена в розмірах. Селезінка зазвичай збільшена. Кровотечі з гемороїдальних вен не є масивними і грізними. Часто задовго до жовтяниці з’являється свербіння шкіри. На шкірі знаходять “судинні зірочки”, пальмарну еритему долонь. У чоловіків – гінекомастія та імпотенція, у жінок – аменорея, атрофія молочних залоз. На передній черевній стінці caput medusaе. В крові гіперспленічна тріада: анемія, лейкопенія, тромбоцитопенія.
Відтак, одним з найважливіших симптомів внутрішньопечінкової портальної гіпертензії є асцит, він є ознакою декомпенсації, порушення функції печінки і розладів портального кровобігу.
Добова кількість сечі не перевищує 300-400 мл. Діуретики перестають давати ефект, шо є поганою прогностичною ознакою.
У випадку, коли розвивається тромбофлебіт вен портальної системи (пілефлебіт) з’являється лихоманка, яка триває довго і супроводжується епізодами езофагогастральних кровотеч.
Лікування портальної гіпертензії має бути комплексним – терапевтичним і хірургічним. З метою зниження портальної гіпертензії застосовують соматостатин (стиламін) внутрішньовенно крапельно 3000 мг впродовж 12-24 годин, який ефективний у 90% випадків, в подальшому застосовують пропранолол по 40-80 мг довгостроково.
Хірургічне лікування портальної гіпертензії здійснюється в двох випадках: в ургентному порядку на висоті гострої профузної кровотечі з метою її зупинки і в плановому порядку з метою стійкого зниження портального тиску і усунення асциту та гіперспленізму.
В ургентних умовах при дифузній езофагогастральній кровотечі ефективні тампонада стравоходу, в тому числі черезстравохідна з допомогою езофагоскопа, впорскування у варикозні вени склерозуючого 66% розчину глюкози, задня медіастинотомія з тампонадою середостіння, методи деваскуляризації кардіального відділу шлунка, абдомінальної частини стравоходу, гастректомія тощо.
З планових хірургічних методів заслуговує уваги спленоренальний анастомоз з видаленням селезінки, який усуває не лише портальну гіпертензію, але й явища гіперспленізму.
В арсеналі лікаря-хірурга є й інші методики лікування портальної гіпертензії (порто-кавальний, мезентерико-кавальний, каво-мезентеріальний анастомози тощо).
Асцит. Утворення асциту при ЦП є наслідком багатьох чинників: механічного порушення циркуляції крові в системі ворітної вени, зміна колоїдно-осмотичного тиску, гіпопротеїнемія, гормональні розлади, ниркові фактори.
Застій у системі ворітної вени внаслідок механічної перешкоди кровобігу є серйозною, але не єдиною умовою розвитку асциту. Винятком при цьому є хіба що закупорка печінкової вени.
Основним механічним моментом, який дає початок утворенню асциту, є збільшення постсинусоїдального опору кровобігу в печінці. При цьому частково внаслідок закупорки печінкових лімфатичних судин, частково в результаті підвищеного лімфоутворення на поверхні печінки в черевну порожнину виділяється підвищена кількість лімфи. Нагромадженню рідини сприяє також підвищення проникливості капілярів і гіпоальбумінемія. Остання сприяє зниженню внутрішньосудинного колоїдно-осмотичного тиску, внаслідок чого починається вихід рідини в тканини. Рідина в черевній порожнині спочатку добре дренується всмоктуванням через потужну лімфатичну систему парієтальної очеревини. Якщо ж поступлення рідини в черевну порожнину переважає над дренажною здатністю очеревини, то багата на білок рідина в черевній порожнині створює осмотичні умови для підвищеної ультрафільтрації з судин парієнтальної очеревини.
Велике значення в підтримці постійності водного середовища належить ниркам, які регулюють вміст натрію і води в організмі. Ця функція тісно зв’язана з продукцією мінералокаортикоїдів наднирковими залозами і серцево-судинними факторами.
При ЦП спостерігається підвищене виділення альдостерону, який посилює реабсорбцію натрію в дистальних канальцях нирок і виведення калію та іонів водню.
Гіперальдостеронемія при ЦП може бути зумовлена двома механізмами: 1) гіповолемією внаслідок виходу рідини із судинного русла, що стимулює вироблення альдостерону корою надниркових залоз; 2) пониженням здатності печінки інактивувати гормони, в тому числі й альдостерон, що спричиняє вторинний гіперальдостеронізм.
Затримка натрію викликає порушення тканинних осморецепторів і через так званий антидіуретичний рефлекс стимулює секрецію антидіуретичного гормону задньої долі гіпофізу. При цьому зростає реабсорбція води в ниркових канальцях, таким чином вода затримується у тканинах до тих пір, поки не відновиться осмотична рівновага.
Лікування набряково-асцитичного синдрому. Хворому з асцитом призначається ліжковий режим, який зменшує явища вторинного гіперальдостеронізму. Щоденно треба вимірювати добовий діурез, артеріальний тиск, частоту пульсу, масу тіла, здійснювати контроль за рівнем електролітів, альбуміну, сечовини, креатиніну.
Дієта при асциті. Кількість білка в добовому раціоні складає 1г на 1 кг маси тіла (70-80 гр), в тому числі 40-50 г білків тваринного походження; вуглеводів – 300-400 г; жирів – 80-90 г. Енергетична цінність раціону – 1600-2000 ккал. Вміст солі в раціон 0, 5-2 г на добу. Кількість рідини при відсутній нирковій недостатності – біля 1, 5 л на добу. Діурез слід підтримувати на рівні 1-1, 5 л на добу.
Сечогінна терапія. Якщо при дотриманні ліжкового режиму і безсольової дієти добовий діурез хворого з асцитом менше 500 мл/добу, необхідно починати лікування діуретиками. Спочатку призначають антагоністи альдостерону – верошпірон, альдактон, спіронолактон. Блокуючи дію альдостерону, вони гальмують реабсорбцію натрію і посилюють його екскрекцію з сечею. При цьому калій затримується в організмі.
Починають лікування з 75-150 мг/добу верошпірону, при неефективності через тиждень дозу збільшують до 200 мг/добу. У разі ж надмірного діурезу дозу зменшують до 25-50 мг/добу.
При відсутності ефекта від лікування антагоністами альдостерону додають фуросемід (лазикс) – одноразово по 40-80 мг зранку щодня або 2-3 рази на тиждень на фоні щоденного прийому верошпирону в дозі 100-150 мг/добу. При досягненні позитивного ефекту переходять на прийом верошпирону в дозі 75 мг/добу і фуросеміду в дозі 20-40 мг 1 раз в 7-14 днів. Раціональна також комбінація альдактону з гіпотиазидом, при цьому забезпечується блокада реабсорбції натрію в проксимальних і дистальних канальцях. Гіпотиазид при цьому призначають по 50-100 мг/добу 2-3 дні в тиждень.
При впертому асциті можна рекомендувати на 1-2 дні наступні комбінації:
1) фуросемід 80 мг + гіпотиазид 100 мг + альдактон 200 мг;
2) фуросемід 80 мг + арифон 2, 5 мг + альдактон 200 мг;
3) фуросемід 80 мг + оксодолін 100 мг + альдактон 200 мг;
4) арифон 2, 5 мг + спіронолактон 200 мг.
Допомагає добитись належного діурезу (півтора-два рази більшого, ніж кількість спожитої рідини) 20% розчин альбуміну або нативна чи свіжозаморожена плазма. Разова доза плазми складає 125-150 мл, 4-5 вливань на курс; 20% розчин альбуміну вводять по 100 мл внутрішньовенно, 5-6 інфузій на курс. Білкові препарати сприяють підвищенню альбуміну в крові і колоїдно-осмотичного тиску плазми, внаслідок чого рідина рухається з тканин у судинне русло, а далі виводиться нирками.
Якщо з’являються ознаки гіпокаліємії, слід застосувати 4% розчин хлориду калію по 40-50 мл в 300-400 мл ізотонічного розчину натрію хлориду, прийом продуктів, багатих на калій.
Абдомінальний парацентез застосовують лише у випадках, коли асцит рефрактерний до лікування дієтою, антагоністами альдостерону та їх комбінацією з фуросемідом, гіпотиазидом, арифоном (індапамідом), білковими препаратами. Об’єм рідини, що вилучається з черевної порожнини не повинен перевищувати 3 літрів, бо при цьому може різко знизитись внутрішньочеревний тиск з падінням артеріального тиску. Перед проведенням парацентезу доцільно внутрішньовенно ввести 30-40 г альбуміна.
Асцитосорбція – метод, при якому 2-3 л асцитичної рідини пропускають через сорбційні колонки, очищаючи в такий спосіб від токсичних метаболітів, і потім вводять її внутрішньовенно.
З хірургічних методів лікування асциту заслуговує уваги спосіб накладання перитонеовенозного шунта, при якому асцитична рідина з черевної порожнини поступає у венозне русло. Такий метод не показаний при вираженій печінковій недостатності та кровотечах з варикознорозширених вен стравоходу.
Портосистемна енцефалопатія. Під назвою “портосистемна енцефалопатія” (portal – systemic encephalopathy) Scherlock et al (1954) описали захворювання нервової системи, яка виникає у хворих на ЦП. Розвиток її обумовлюється тим, що азотвмісні речовини кишечника минають печінку або проходять крізь неї в незміненому вигляді, потрапляють в системний кровобіг і викликають мозкові розлади. Речовини, до складу яких входить амоніак утворюються з харчового білка та з крові, яка вилилась в шлунково-кишковий тракт з варикозно розширених вен. Важливе значення в їх утворенні належить паталогічній мікрофлорі кишечника. Азотвмісні токсичні продукти можуть минати паренхіму печінки крізь порто-кавальні анастомози та сполучення між розгалуженнями ворітної і печінкової вен. При важкій печінково-клітинній недостатності не потрібно навіть колатерального кровобігу, щоб амоніак потрапив в загальний кровотік, адже при цьому різко знижена детоксикаційна функція печінки.
Головними клінічними ознаками цього синдрому є розлади свідомості, які проявляються періодичним ступором та комою. Перед виникненням амоніакової коми виникають зміни у психіці хворого: збудження, поведінка неадекватна обстановці, тремор, мимовільні рухи пальців, атаксія, судома мімічної мускулатури, птоз повік, звисання язика з рота. Рефлекси і м’язовий тонус спочатку підвищені, а згодом при розвитку коми – знижуються аж до повної арефлексії. Рідше виникають розлади сну, маячіння, порушення зору, мови. Часто хворий вмирає в коматозному стані внаслідок печінково-клітинної недостатності. Іноді ж приступ закінчується відновленням свідомості, зникненням ознак ураження нервової системи.
На відміну від так званої справжньої печінкової коми, зумовленої прогресуючим некрозом печінкових клітин (така кома часто є зворотньою), розрізняють ще так звану псевдопечінкову кому з втратою свідомості, викликаною в першу чергу гіповолемією. Але оскільки отруєння амоніаком і гіповолемія відіграють значну роль в патогенезі справжньої печінкової коми, відрізнити її від псевдопечінкової дуже важко.
У виникненні печінкової енцефалопатії велике значення мають ароматичні амінокислоти фенілаланін, тирозин, триптофан, які не піддаються печінковому метаболізму за наявності портокавальних апастомозів. Некротоксичні речовини пригнічують фізіологічні процеси в мозку, гальмують продукцію енергії в мозковій тканині, знижують мембранний потенціал мозкових клітин, гальмують передачу збудження в синапсах, пригнічують, врешті-решт, ЦНС.
Лікування хронічної печінкової енцефалопатії.
Дієта. Різко зменшується кількість білка в добовому раціоні – до 30-50 г, причому рекомендуються переважно білки рослинного походження. Кількість жирів в добовому раціоні складає 80 г (переважно рослинних), вуглеводів – 200-300 г, енергетична цінність 500-1700 ккал. Рекомендуються овочеві супи, каші, картопляне пюре, киселі, фрукти, соки, лимонад. Припиняється введення білкових препаратів. Зменшення білка в раціоні інгібує утворення амоніака і ароматичних амінокислот. З метою усунення амоніакової інтоксикації і гіперазотемії рекомендується наступне лікування.
Пригнічення амоніактвірної флори у кишечнику – досягають з допомогою високих очисних клізм 1-2 рази на добу та ведення в кишечник антибактеріальних препаратів, які пригнічують амонієгенну кишечну флору (метронідазол, мономіцин, канаміцин).
Лактулоза (нормазе, порталак) – це синтетичний дисахарид (бета-1, 4-галактозидофруктоза), який гідролізується кишковими бактеріями до молочної кислоти, яка створює в кишечнику кисле середовище, в якому унеможливлюється ріст і розмноження амоніяктвірної флори. До того ж лактулоза підвищує осмотичний тиск в кишечнику й діє послаблююче. Сироп лактулози приймають по 30 мл 3-5 разів на день після їди до легкого послаблюючого ефекту.
Тепер використовують лактиол-дисахарид, близький до лактулози, але з менш солодким смаком, він не всмоктується в тонкій кишці, але активно метаболізується бактеріальною флорою товстої кишки. Призначають всередину у вигляді порошка.
Орніцетил – це альфа-кетоглюконат орнітину, який зв’язує амоніак. Випускається у флаконах по 5 г нейтрального – кетоглюконата орнітину у вигляді ліофілізата для інтравенозних введень і в флаконах 2 г для внутрішньом’язових введень. Показаний при ЦП з вираженою печінково-клітинною недостатністю.
Глутамінова кислота. Сприяє знешкодженню і виведенню амоніака з організму, підвищує стійкість до гіпохолії, сприяє синтезу аденозинтрифосфорної кислоти. Як нейромедіатор вона стимулює передачу збудження в синапсах ЦНС. Вводиться внутрішньовенно краплинно по 300-500 мл 1% розчину.
Менш ефективне лікування амінокислотами альвезином, поліаміном.
Корекція метаболічного алкалозу. Причиною його можуть бути тіазидні та петльові діуретики. В таких випадках призначають внутрішньовенно 4% розчин калію хлориду по 50-80 мл в 500-1000 мл 5% розчину глюкози.
Дезінтоксикаційна терапія проводиться 5% розчином глюкози (500-1000 мл/добу), розчинами Рінгер-Лока, натрію хлориду, альбуміном (100-150 мл 10-20% розчину внутрішньовенно краплинно) в поєднанні з вітамінами С (1000 мг/добу), тіаміном (50 мг/добу), кокарбоксилазою (200-400 мг/добу). Широко використовують ентеросорбенти – ентеросорбент СКН – по 110 г 3 рази на день 10-14 днів, ентеродез – по 5 г в 100 мл кип’яченої води 1-3 рази на день, белосорб – по 1 чайній ложці 3 рази на день в 1/2 склянки кип’яченої води. Іноді вдаються до гемосорбції та гемофільтрації.
З рослинних препаратів використовують фалькамін – по 1 пакетику в невеликій кількості води в час їди 3 рази на день. В 1 пакетику фалькаміну є 3, 62 г лейцина, 1, 94 г валіна, 1, 45 г ізолейцина, рівень яких при портосистемній енцефалопатії знижений.
При наявності синдрому гіперспленізму призначають стимулятори лейкопоезу: нуклеїновокислий натрій по 0, 3 г 3-4 рази на день від 2 тижнів до 3 місяців, пентоксил по 0, 2 г 3 рази на день упродовж 2-3 тижнів.
При відсутності ефекту від застосування імуностимуляторів призначають преднізолон в добовій дозі 20-40 мг упродовж 2-3 місяців з поступовим зниженням дози.
В разі зниження гемоглобіну до 50 г/л, числа тромбоцитів до 50-109/л і нижче застосовують переливання еритроцитарної і тромбоцитарної маси.
В окремих випадках вираженого гіперспленізму проводиться спленектомія або емболізація селезінкової артерії.
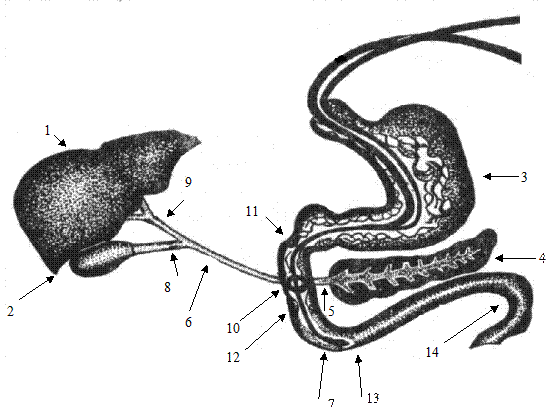 |
Рис. Розташування органів травної системи і гастродуоденального зонда:
1- печінка, 2 - жовчний міхур, 3 - шлунок, 4 - підшлункова залоза, 5 - головна протока підшлункової залози, 6 - загальна жовчна протока, 7 - олива
дуоденального зонда, 8 - замикач Люткенса-Мартинова, 9 - замикач Міріцці, 10 - замикач Одді, 11 - бульбо-дуоденальний замикач, 12 - медіо-дуоденальний замикач Капанджі, 13 - дистальний замикач дванадцятипалої кишки Окснера, 14 - Трейцева зв’язка.