
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Валентність Брому і за електронною конфігурацією
|
|
 35Br … 4 s 24 p 5 … B = 1,
35Br … 4 s 24 p 5 … B = 1,
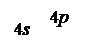
І в сполуці дорівнює одиниці, отже, він знаходиться в нормальному стані.
Валентний електрон Брому, що бере участь в утворенні зв’язку, міститься на p-атомній орбіталі, яка має форму гантелі. Таким чином, у молекулі BBr3 реалізуються три s-зв’язки за обмінним механізмом. Зі схеми видно, що ці три s-зв’язки утворюються внаслідок перекривання трьох гібридизованих одноелектронних орбіталей атома Бору з одноелектронними р-орбіталями трьох атомів Брому. Одна валентна (вільна) р-орбіталь атома Бору залишається негібридною, вона не змінює геометричної конфігурації молекули, а тому не показана на малюнку. За рахунок наявності цієї вільної орбіталі атома Бору можливе подальше утворення не одного хімічного зв’язку, наприклад, за донорно-акцепторним механізмом.
Молекула BBr3 має площинну конфігурацію з валентними кутами 120°, тому вона симетрична та неполярна  .
.
 в) У нормальному стані атом Карбону двовалентний
в) У нормальному стані атом Карбону двовалентний
6C … 2 s 22 p 2 … B = 2,
|
|
 а в сполуці СCI4 він чотиривалентний, тобто знаходиться у збудженому стані:
а в сполуці СCI4 він чотиривалентний, тобто знаходиться у збудженому стані:
С* … 2 s 12 p 3 … B * = 4.

Чотири рівноцінні зв’язки з атомами Йоду потребують sp 3-гібридизації центрального атома з валентними кутами приблизно 109, 5°.
Електронна формула атома Йоду:
|
|
 53І … 5 s 25 p 5 … B = 1,
53І … 5 s 25 p 5 … B = 1,
 тобто він знаходиться у нормальному стані. Чотири рівноцінні зв’язки з атомами Йоду потребують sp 3-гібридизації центрального атома з валентними кутами приблизно 109, 5°.Валентний електрон Йоду, що бере участь в утворенні s - зв’язку за обмінним механізмом, знаходиться на р -атомній орбіталі (гантелеподібна форма).Просторово чотири гібридні орбіталі атома Карбону реалізуються в напрямку від центра тетраедра (ядро атома Карбону) до його вершин. Оскільки всі зв’язки в молекулі ССІ4 рівноцінні, вона симетрична і неполярна
тобто він знаходиться у нормальному стані. Чотири рівноцінні зв’язки з атомами Йоду потребують sp 3-гібридизації центрального атома з валентними кутами приблизно 109, 5°.Валентний електрон Йоду, що бере участь в утворенні s - зв’язку за обмінним механізмом, знаходиться на р -атомній орбіталі (гантелеподібна форма).Просторово чотири гібридні орбіталі атома Карбону реалізуються в напрямку від центра тетраедра (ядро атома Карбону) до його вершин. Оскільки всі зв’язки в молекулі ССІ4 рівноцінні, вона симетрична і неполярна  Завдання 6. Пояснити, чому молекула BeH2 неполярна, а молекула H2O полярна, хоча обидві мають полярні зв’язки Be-H та O-H.
Завдання 6. Пояснити, чому молекула BeH2 неполярна, а молекула H2O полярна, хоча обидві мають полярні зв’язки Be-H та O-H.
Розв’язання. Щоб визначити підсумковий дипольний момент молекули, треба знайти векторну суму дипольних моментів усіх зв’язків. Молекула BeH2, хоч і має два полярні зв’язки Be-H, є лінійною та симетричною внаслідок sp -гібридизації атомних орбіталей центрального атома Берилію, тому її сумарний дипольний момент дорівнює нулю (див. завдання 5):
 H Be H
H Be H  = 0.
= 0.
У несиметричній кутовій молекулі Н2О внаслідок sp 3-гібридизації орбіталей  атома Окси-гену наявний підсумковий дипольний момент
атома Окси-гену наявний підсумковий дипольний момент  , тобто молекула Н2О полярна. Детальніше обґрунтування подано у задачі 4.
, тобто молекула Н2О полярна. Детальніше обґрунтування подано у задачі 4.
Завдання 7. Визначити й обґрунтувати типи гібридизації атомних орбіталей, зобразити електронні конфігурації молекул: а) СO2; б) кисню О2.
Розв’язання. Визначаючи тип гібридизації атомних орбіталей, треба пам’ятати, що гібридні атомні орбіталі не можуть брати участі в утворенні p-зв’язків. Останній реалізується негібридними d - або р -орбіталями.
а) Електронна конфігурація валентного рівня атома Карбону в нормальному стані становить:
 6С … 2 s 22 p 2 … B = 2.
6С … 2 s 22 p 2 … B = 2.
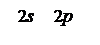
 У молекулі О = С = О валентність Карбону дорівнює чотирьом, тобто в цій сполуці атом Карбону знаходиться у збудженому стані.
У молекулі О = С = О валентність Карбону дорівнює чотирьом, тобто в цій сполуці атом Карбону знаходиться у збудженому стані.
6C*… 2 s 12 p 3 …  B * = 4.
B * = 4.
 Оксиген у молекулі знаходиться в нормальному стані, оскільки його валентність і за електронною конфігурацією і у сполуці дорівнює двом:
Оксиген у молекулі знаходиться в нормальному стані, оскільки його валентність і за електронною конфігурацією і у сполуці дорівнює двом:
|
|
Атом Карбону з кожним із двох атомів Оксигену утворює один s- та один p-зв’язки, оскільки в нього дві атомні орбіталі підлягають sp -гібридизації, а дві негібридні р -орбіталі беруть участь в утворенні двох p-зв’язків.
Кожний з атомів Оксигену також утворює з атомом Карбону один s- та один p-зв’язок; він підлягає sp 2-гібридизації А.О., а також одна р -орбіталь у нього залишається негібридною. Атом Карбону не має незв’язуючих орбіталей, тоді як у кожного з атомів Оксигену є по дві незв’язуючі атомні орбіталі.

Саме sp -гібридизація А.О. центрального атома (Карбону) визначає лінійну симетричну будову молекули СО2. Внаслідок симетричної будови молекули її підсумковий дипольний момент дорівнює нулю ( = 0), тобто молекула в цілому є неполярною.
= 0), тобто молекула в цілому є неполярною.
Слід зазначити, що уявлення про гібридизацію атомних орбіталей під час
утворення хімічного зв’язку – це квантово-механічний метод, який дозволяє пояснити просторову конфігурацію молекул перебудовою їх вихідних атомних орбіталей на гібридні. Атоми одного й того самого елемента здатні утворювати різноманітні хімічні сполуки з різними валентними кутами, тобто можлива реалізація різних типів гібридизації атомних орбіталей. Наприклад, у молекулі метану СН4 здійснюється sp 3-гібридизація орбіталей Карбону (валентні кути 109, 5°); в молекулі етану Н3С-СН3 також обидва атоми Карбону перебувають у sp 3-гібридному стані.
Однак у молекулі етену Н2С  СН2 атом Карбону окрім гібридних А.О. має одну негібридну атомну орбіталь, яка бере участь в утворенні p-зв’язку із сусіднім атомом Карбону. Тому в цьому випадку відбувається sp 2-гібридизація А.О. кожного з атомів Карбону (валентні кути 120°) з утворенням трьох гібридних орбіталей, що утворюють три s-зв’язки.
СН2 атом Карбону окрім гібридних А.О. має одну негібридну атомну орбіталь, яка бере участь в утворенні p-зв’язку із сусіднім атомом Карбону. Тому в цьому випадку відбувається sp 2-гібридизація А.О. кожного з атомів Карбону (валентні кути 120°) з утворенням трьох гібридних орбіталей, що утворюють три s-зв’язки.
У молекулі етину НС  СН, як і в розглянутій вже молекулі СО2, реалізується sp -гібридизація атомних орбіталей Карбону, а дві негібридні р -орбіталі утворюють два p-зв’язки. Отже, у наведених сполуках (CH4, C2H4, C2H2) атоми Карбону перебувають у різних гібридизованих станах.
СН, як і в розглянутій вже молекулі СО2, реалізується sp -гібридизація атомних орбіталей Карбону, а дві негібридні р -орбіталі утворюють два p-зв’язки. Отже, у наведених сполуках (CH4, C2H4, C2H2) атоми Карбону перебувають у різних гібридизованих станах.
б) Електронна будова валентного рівня атома Оксигену становить:
8О … 2 s 22 p 4  B = 2.
B = 2.

Валентність Оксигену в молекулі кисню О2 також дорівнює двом (О = О), тобто в 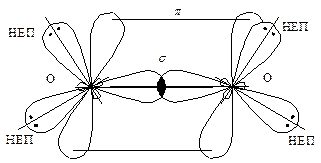 молекулі кисню реалізується один s- і один p-зв’язок. Оскільки гібридні атомні орбіталі не можуть утворювати
молекулі кисню реалізується один s- і один p-зв’язок. Оскільки гібридні атомні орбіталі не можуть утворювати
p-зв’язок, кожний з атомів Оксигену в молекулі О2 перебуває в sp 2-гібридизованому стані, а p-зв’язок утворюється негібридними p -орбіталями.