
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Температурная зависимость теплового эффекта (энтальпии) реакции
|
|
Чтобы рассчитать температурную зависимость энтальпии реакции, необходимо знать мольные теплоемкости веществ, участвующих в реакции. Изменение энтальпии реакции при увеличении температуры от Т1 до Т2 рассчитывают по закону Кирхгофа (предполагается, что в данном интервале температур мольные теплоемкости не зависят от температуры и нет фазовых превращений):

Если в данном интервале температур происходят фазовые превращения, то при расчёте необходимо учесть теплоты соответствующих превращений, а также изменение температурной зависимости теплоемкости веществ, претерпевших такие превращения:

где Δ Cp(T1, Tf) — изменение теплоемкости в интервале температур от Т1 до температуры фазового перехода; Δ Cp(Tf, T2) — изменение теплоемкости в интервале температур от температуры фазового перехода до конечной температуры, и Tf — температура фазового перехода.

Билет 13:
1.Методы защиты от электрохимической коррозии.

2.скорость реакции. Влияние температуры на скорость реакции. Правило вант-гоффа, уравнение аррениуса.


 \
\
Билет 14:
1.Энергия активации. Аналитический и графический способ ее определения.
Энергия активации — минимальное количество энергии, которое требуется сообщить системе (выражается в джоулях на моль), чтобы произошла реакция.
Уравнение Аррениуса устанавливает связь между энергией активации и скоростью протекания реакции:
 ,
,
где k — константа скорости реакции, 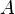 — фактор частоты для реакции,
— фактор частоты для реакции,  — универсальная газовая постоянная,
— универсальная газовая постоянная,  — температура в кельвинах.
— температура в кельвинах.
С повышением температуры растёт вероятность преодоления энергетического барьера.
Для количественного описания температурных эффектов в химической кинетике для приближённых вычислений кроме уравнения Аррениуса используют правило Вант-Гоффа: повышение температуры на 10 К увеличивает для большинства реакций скорость в 2-4 раза. Математически это означает, что скорость реакции зависит от температуры степенным образом:

где  — температурный коэффициент скорости
— температурный коэффициент скорости

2. законы Фарадея. Электрорафинированние металлов. Процесс электрорафинирования меди..

Электро́ лиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохожденииэлектрического тока через раствор, либо расплав электролита.
Большое количество металлов извлекается из руд и подвергается переработке с помощью электролиза (электроэкстракция, электрорафинирование). Также электролиз является основным процессом, благодаря которому функционирует химический источник тока.


Билет 15:
1. Электродный потенциал. Газовые электроды.
Электродный потенциал – это разность электростатических потенциалов между электролитом и электродом. Возникновение такого потенциала обусловлено пространственным разделением зарядов, которые имеют противоположные знаки на границе разделения фаз с образованием электрического двойного слоя.
Газовые электроды

2. Условия равновесия химической реакции. Принцип Ле-Шателье.

Билет16:
1.скорость химической реакции. Зависимость скорости химической реакции от концентрации реагирующих веществ.

Зависимость от концентрации

2.источники электрической энергии. Гальванические элементы, топливные элементы, аккумуляторы.

Гальванические элементы — это первичные химические источники тока, в которых химические реакции необратимы. В простейшем виде элемент представляет собой два электрода из разных металлов, погруженных в раствор электролита. При этом на одном из электродов (катоде) идет реакция растворения материала электрода - или окисления, при которой электрод теряет электроны, отдавая их во внешнюю электрическую цепь.
На другом электроде (аноде) идет реакция восстановления— нейтрализации ионов материала, окружающего электрод, за счет электронов, поступающих с катода по внешней цепи. Разность потенциалов (электродвижущая сила) для различных элементов находится в пределах от 0, 85 до 6 В.
топливный элемент — электрохимическое устройство, подобное гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне — в отличие от ограниченного количества энергии, запасенного вгальваническом элементе или аккумуляторе.

Билет 17:
1. Кинетическое уравнение реакции первого порядка. Период полураспада.

2. Какие электрохимические процессы протекают при нарушении цинкового покрытия на железе, если коррозия протекает: а) в кислой среде, б) в атмосферних условиях.
Коррозия – это самопроизвольное разрушение металлов под действием окружающей среды.
В большинстве случаев коррозия протекает по электрохимическому механизму. Электрохимическая коррозия возникает во влажных средах и
Связана с возникновением коррозионного гальванического элемента. При электрохимической коррозии анодным процессом является окисление металла, а катодным – в большинстве случаев – восстановление ионов водорода или растворенного в воде кислорода.


Билет 18:
1. Классификация электродов. Окислительно-восстановительные реакции.


2.изменению каких функций состояния равны тепловые эффекты изобарного и изохорного процессов.