
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Уровни структурной организации хроматина
|
|
Молекулы ДНК имеют диаметр 2 нм, но их длина в хромосомах может достигать нескольких сантиметров. Очевидно, что упаковка таких длинных молекул в объеме клеточного ядра, имеющего диаметр всего 5-8 мкм, должна быть в высшей степени регулярной. Проблема укладки молекул ДНК в ограниченном объеме ядра осложняется еще и тем, что одновременно необходимо обеспечить возможность локальной распаковки ДНК и доступа к ней ферментов репликации и транскрипции. Вот почему хроматин в клеточном ядре образует сложные пространственные структуры с несколькими уровнями организации.
Первый уровень укладки ДНК в хроматине обеспечивается нуклеосомами. Они представляют собой округлые частицы диаметром 15 нм, которые связаны между собой участками ДНК длиной около 20 нм. Отдельная нуклеосома состоит их белковой сердцевины, на которую накручена молекула ДНК.
Белковая сердцевина нуклеосомы, или кор, имеет форму диска диаметром 11 нм и толщиной 6 нм. Она содержит по две молекулы гистонов H2A, H2B, H3 и H4. Если развернуть сердцевину, то можно обнаружить, что молекулы гистонов соединены в последовательности H2A, H2B, H4, H3, H3, H4, H2B, H2A. При сворачивании сердцевины молекулы гистонов располагаются как бы в два этажа, наподобие винтовой лестницы.
Молекула ДНК в виде левозакрученной суперспирали совершает 1, 75 оборота вокруг сердцевины. При этом в непосредственный контакт с гистонами вступает 146 пар нуклеотидов. Длина линкерной ДНК, соединяющей соседние нуклеосомы, колеблется в пределах 40-70 пар нуклеотидов в зависимости от типа клетки. Таким образом, на одну нуклеосому приходится в среднем около 200 пар нуклеотидов ДНК.
Нуклеосомы укорачивают молекулу ДНК примерно в 7 раз. Они обнаружены во всех эукариотических клетках и даже у ДНК-содержащих вирусов. Однако это не означает, что вся ДНК клеточного ядра связана с нуклеосомами, и некодирующие повторы могут иметь другую укладку.
Второй уровень укладки ДНК обеспечивается взаимодействием линкерной ДНК с гистоном H1. Молекула гистона H1 своим глобулярным доменом связывается с двумя витками ДНК на нуклеосоме. Одновременно C-концевой фибриллярный домен гистона H1 вступает в контакт с линкерной ДНК. В результате соседние нуклеосомы приближаются друг к другу, формируя группы из 6-8 частиц – нуклеомеры (супербусины) диаметром 25-30 нм.
Последовательность аминокислот в C-домене гистона H1 гомологична первичной структуре некоторых регуляторов транскрипции. В связи с этим предполагается, что гистон H1 конкурирует с факторами транскрипции за связывание с линкерной ДНК, контролируя тем самым активность генов.
Третий уровень укладки ДНК представлен хроматиновыми фибриллами диаметром 30 нм, которые хорошо видны в электронном микроскопе в интерфазных ядрах и митотических хромосомах. Они имеют суперспиральную структуру и содержат максимально сближенные между собой нуклеомеры. В формировании фибрилл диаметром 30 нм принимают участие гистон H1, а также негистоновые белки с HMG-доменом. За конденсацию хроматина в фибриллу диаметром 30 нм отвечает, прежде всего, C-концевой домен гистона H1. При этом первостепенное значение приобретает уже не взаимодействие гистона с ДНК, а взаимные связи гистоновых молекул между собой.
Образование нуклеомеров и хроматиновых нитей диаметром 30 нм вызывает дальнейшую компактизацию ДНК в 40-50 раз.
Четвертый уровень укладки ДНК обеспечивается взаимодействием фибрилл диаметром 30 нм с ядерным матриксом. При этом формируются петлевые домены, содержащие в среднем 90 тысяч пар нуклеотидов. В расправленном состоянии их длина может достигать 20 мкм. Концы таких петель прикреплены к ядерному матриксу в особых точках, обозначаемых как MARs (matrix attachment regions) или SARs (scaffold attachment regions). Эти точки содержат молекулы свободной ДНК (“форум-ДНК”) длиной 50-150 пар нуклеотидов, которые устойчивы к действию нуклеаз и выделяются из ядра независимо от высокомолекулярной ДНК. Точки MARs содержат также топоизомеразу II, участвующую в формировании изгибов ДНК. Со стороны ядерного матрикса прикрепление хроматиновых нитей обеспечивается ламином A.
Петлевые домены являются типовой структурно-функциональной единицей хроматина. Домен во многом автономен, независимо реплицируется и транскрибируется. В своем составе домены имеют кластеры генов, которые связаны функционально. Петлевые домены обеспечивают компактизацию молекулы ДНК в 700 раз.
Пятый уровень укладки ДНК связан с формированием групп из 18-20 петлевых доменов, прикрепленных в виде розетки к общему центру из белков ядерного матрикса. Розетки из петлевых доменов находятся в хроматине в компактном состоянии, образуя округлые гранулы диаметром около 150 нм – хромомеры. При активации локализованных в хромомере генов его величина может возрастать до 300 нм и более.
Шестой уровень укладки ДНК определяется формированием хромонемы – фибриллярной структуры диаметром 200-300 нм, состоящей из плотно упакованных хромомеров.В хроматине интерфазного ядра хромонемы обычно не выявляются. Они становятся видимыми только при конденсации хроматина в профазе митоза, а также в ранней телофазе при деконденсации хромосом. Хромомерный и хромонемный уровни укладки позволяют укоротить длину молекулы ДНК в 10 000 раз.
Седьмой уровень укладки ДНК состоит в образовании хроматид (однохроматидных хромосом) из хромонем. Толщина хроматиды составляет в среднем 700-800 нм. Если учесть, что толщина хромонемы обычно равна 100-200 нм, то коэффициент упаковки для хромосомного уровня составляет не более 10. Способ укладки хромонемы в хромосоме изучен недостаточно. У одних видов хромонема имеет вид спирали, у других в одной хромосоме могут обнаруживаться две и более параллельные друг другу хромонемы. Хромосомный уровень укладки ДНК в большей степени, чем другие уровни, отражает видовые особенности организации генома эукариот.
Каждый вид, как известно, имеет характерный для него набор хромосом. Однако хромосомы можно наблюдать в микроскоп только при делении клеток митозом или мейозом. В ядрах неделящихся клеток хромосомы находятся в деконденсированном состоянии, образуя хроматин. Тем не менее, даже в интерфазном ядре хромосомы сохраняют свою индивидуальность, занимая в нем определенные хромосомные территории. Согласно К. Раблю (1885) хромосомы прикреплены к нуклеолемме теломерными концами, тогда как центромерные участки располагаются ближе к центру ядра. Новейшие исследования интерфазного ядра с помощью конфокальной микроскопии подтверждают эту концепцию, добавляя к ней ряд существенных деталей. В частности, гомологичные хромосомы локализованы на противоположных сторонах ядра. При активации генов и сопутствующей этому деконденсации хромосомы удлиняются, смещаясь к центру ядра. Вот почему в животных и некоторых растительных клетках гетерохроматин концентрируется преимущественно по периферии, тогда как эухроматин занимает центральную область ядра.
11. Синтез белка: транскрипция и трансляция.
Носителем всей генетической информации является ДНК, расположенная в ядре клетки.
Сам синтез белка происходит в цитоплазме клетки, на рибосомах. Из ядра в цитоплазму информация о структуре белка поступает в виде информационной РНК (и-РНК).
Для того чтобы синтезировать и-РНК, участок ДНК «разматывается», деспирализуется, а затем по принципу комплементарности на одной из цепочек ДНК с помощью ферментов синтезируются молекулы РНК. Это происходит следующим образом: против, например, гуанина молекулы ДНК становится цитозин молекулы РНК, против аденина молекулы ДНК — урацил РНК, против тимина ДНК — аденин РНК и против цитозина ДНК — гуанин РНК. Так же формируется цепочка и-РНК, представляющая собой точную копию второй цепи ДНК (только тимин заменен на урацил). Таким образом, информация о последовательности нуклеотидов какого-либо гена ДНК «переписывается» в последовательность нуклеотидов и-РНК. Этот процесс получил название транскрипции. У прокариот синтезированные молекулы и-РНК сразу же могут взаимодействовать с рибосомами, и начинается синтез белка. У эукариот и-РНК взаимодействует в ядре со специальными белками и переносится через ядерную оболочку в цитоплазму. В цитоплазме обязательно должен быть набор аминокислот, необходимых для синтеза белка. Эти аминокислоты образуются в результате расщепления пищевых белков. Кроме того, та или иная аминокислота может попасть к месту непосредственного синтеза белка, т. е. в рибосому, только прикрепившись к специальной транспортной РНК (т-РНК). Для переноса каждого вида аминокислот в рибосомы нужен отдельный вид т-РНК. Так как в состав белков входит около 20 аминокислот, существует столько же видов т-РНК. Строение всех т-РНК сходно (рис. 1.14). Их молекулы образуют своеобразные структуры, напоминающие по форме лист клевера. Виды т-РНК обязательно различаются по триплету нуклеотидов, расположенному на «верхушке». Этот триплет, получивший название антикодон, по генетическому коду соответствует той аминокислоте, которую предстоит переносить этой т-РНК. К «черешку листа» специальный фермент прикрепляет обязательно ту аминокислоту, которая кодируется триплетом, комплементарным антикодону.
В цитоплазме происходит последний этап синтеза белка — трансляция. На тот конец и-РНК, с которого нужно начать синтез белка, нанизывается рибосома (рис. 1.15). Рибосома перемещается по молекуле и-РНК прерывисто, «скачками», задерживаясь на каждом триплете приблизительно 0, 2 с. За это мгновение одна т-РНК из многих способна «опознать» своим антикодоном триплет, на котором находится рибосома. И если антикодон комплементарен этому триплету и-РНК, аминокислота отсоединяется от «черешка листа» и присоединяется пептидной связью к растущей белковой цепочке. В этот момент ибосома сдвигается по и-РНК на следующий триплет, кодирующий очередную аминокислоту синтезируемого белка, а очередная т-РНК «подносит» необходимую аминокислоту, наращивающую цепочку белка. Эта операция повторяется столько раз, сколько аминокислот должен содержать «строящийся» белок. Когда в рибосоме оказывается один из триплетов, являющийся «стоп-сигналом» между генами, то ни одна и-РНК к такому триплету присоединиться не может, так как антикодонов к ним у т-РНК не бывает. В этот момент синтез белка заканчивается. Все описываемые реакции происходят за очень короткие промежутки времени. Подсчитано, что на синтез довольно крупной молекулы белка уходит всего около двух минут.
Клетке необходима не одна, а много молекул каждого белка. Поэтому как только рибосома, первой начавшая синтез белка на и-РНК, продвинется вперед, за ней на ту же и-РНК нанизывается вторая рибосома, синтезирующая тот же белок. Затем на и-РНК последовательно нанизываются третья, четвертая рибосомы и т. д. Все рибосомы, синтезирующие один и тот же белок, закодированный в данной и-РНК, называются полисомами. Когда синтез белка окончен, рибосома может найти другую и-РНК и начать синтезировать тот белок, структура которого закодирована в новой и-РНК. Таким образом, трансляция — это перевод последовательности нуклеотидов молекулы и-РНК в последовательность аминокислот синтезируемого белка. Подсчитано, что все белки организма млекопитающего могут быть закодированы всего 2% ДНК, содержащимися в его клетках. Для чего же нужны остальные 98% ДНК? Оказывается, каждый ген устроен гораздо сложнее, чем считали раньше, и содержит не только тот участок, в котором закодирована структура какого-либо белка, но и специальные участки, способные «включать» или «выключать» работу каждого гена.
Вот почему все клетки, например, человеческого организма, имеющие одинаковый набор хромосом, способны синтезировать различные белки: в одних клетках синтез белков идет с помощью одних генов, а в других — задействованы совсем иные гены. Итак, в каждой клетке реализуется только часть генетической информации, содержащейся в ее генах. Синтез белка требует участия большого числа ферментов. И для каждой отдельной реакции белкового синтеза требуются специализированные ферменты.
12. Энергетический обмен и его этапы.
Клеточное дыхание. Высвобождение потенциальной энергии химических связей. Образующиеся в процессе фотосинтеза органические вещества и заключенная в них химическая энергия служат источником веществ и энергии для осуществления жизнедеятельности всех организмов. Однако использование животными, грибами, многими бактериями создаваемых зелеными растениями органических веществ, синтез на их основе специфических для каждого вида соединений возможны лишь после предварительных преобразований, которые заключаются в расщеплении этих сложных веществ до мономеров и низкомолекулярных веществ: полисахаридов — до моносахаридов, белков — до аминокислот, нуклеиновых кислот —до нуклеотидов, жиров —до высших карбоновых кислот и глицерина.Это же касается и содержащейся в органических веществах энергии. Будучи заключенной в химических связях, она недоступна для непосредственного использования клетками, в том числе и клетками растений, которые преобразовали эту энергию из световой в химическую. Для этого потенциальная энергия органических молекул должна быть высвобождена и переведена в пригодную для использования форму.Образование и накопление энергии, доступной клетке, происходит в процессе клеточного дыхания. Для осуществления клеточного дыхания большинству организмов необходим кислород — в этом случае говорят об аэробном дыхании или аэробном высвобождении энергии. Однако некоторые организмы могут получать энергию из пищи без использования свободного атмосферного кислорода, т. е. в процессе так называемого анаэробного дыхания (анаэробного высвобождения энергии).
Таким образом, исходными веществами для дыхания служат богатые энергией органические молекулы, на образование которых в свое время была затрачена энергия. Основным веществом, используемым клетками для получения энергии, является глюкоза.
Аэробное (кислородное) дыхание. Процесс аэробного дыхания можно условно разделить на несколько последовательных этапов. Первый этап — подготовительный, или этап пищеварения, включающий в себя расщепление полимеров до мономеров. Эти процессы происходят в пищеварительной системе животных или цитоплазме клеток. На данном этапе не происходит накопления энергии в молекулах АТФ.
Следующий этап — бескислородный, или неполный. Он протекает в цитоплазме клеток без участия кислорода.
На данном этапе дыхательный субстрат подвергается ферментативному расщеплению. Примером такого процесса является гликолиз — многоступенчатое бескислородное расщепление глюкозы.
В реакциях гликолиза шестиуглеродная молекула глюкозы (С6 расщепляется на две молекулы пировиноградной кислоты (С3). При этом от каждой молекулы глюкозы отщепляется четыре атома водорода и образуются две молекулы АТФ. Атомы водорода присоединяются к переносчику НАД (никотинамидаденинди-нуклеотид), который переходит в свою восстановленную форму НАД - Н + Н+ (НАД очень сходен с НАДФ, т. е. с переносчиком атомов водорода при фотосинтезе).
Суммарная реакция гликолиза имеет вид:

Полезный выход энергии этого этапа — две молекулы АТФ, что составляет 40%; 60% рассеивается в виде тепла.Наиболее важным является кислородный этап аэробного дыхания. Он протекает в митохондриях и требует присутствия кислорода.Продукт гликолиза — пировиноградная кислота — заключает в себе значительную часть энергии, и дальнейшее ее высвобождение осуществляется в митохондриях. Здесь пировиноградная кислота подвергается ферментативному расщеплению
: 
Углекислый газ выделяется из митохондрий в цитоплазму клетки, а затем в окружающую среду.Атомы водорода, акцептированныеНАД и ФАД (кофермент флавинадениндинуклеотид), вступают в цепь реакций, конечный результат которых — синтез АТФ. Это происходит в следующей последовательности (рис. 1.22):
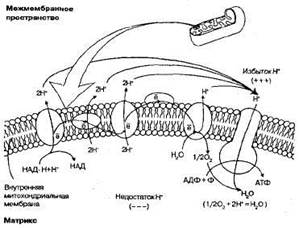
Рис. 1.22. Схема переноса протонов и электронов через внутреннюю мембрану митохондрии в ходе кислородного этапа клеточного дыхания (электронтранспортная цепь).
· атомы водорода отщепляются от НАД и ФАД, захватываются переносчиками, встроенными во внутреннюю мембрану митохондрий, где происходит их окисление:
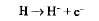
· Н+ выносятся переносчиками на наружную поверхность крист, накапливаются в межмембранном пространстве, образуя протонный резервуар;
· электроны (е-) атомов водорода возвращаются по цепи дыхательных ферментов в матрикс и присоединяются к атомам кислорода, который постоянно поступает в митохондрию. Атомы кислорода при этом становятся отрицательно заряженными:

На мембране возникает разность потенциалов. Когда разность потенциалов достигает 200 мВ, начинает действовать протонный канал в молекулах фермента АТФ-синтетазы, которые встроены во внутреннюю мембрану;
· через протонный канал Н- устремляются обратно в матрикс митохондрий, создавая высокий уровень энергии, большая часть которой идет на синтез АТФ из АДФ и фосфорной кислоты, а протоны соединяются с отрицательно заряженными частицами кислорода, образуя воду — второй конечный продукт клеточного дыхания:
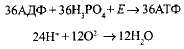
Таким образом, кислород, поступивший в митохондрии, необходим для присоединения электронов, а затем и протонов. При отсутствии кислорода процессы, связанные с транспортом протонов и электронов в митохондриях, прекращаются, а следовательно, невозможно протекание и бескислородного этапа, так как все переносчики атомов водорода оказываются загруженными.
Аэробное дыхание, включающее бескислородный и кислородный этапы, можно выразить суммарным уравнением:

При распаде молекулы глюкозы высвобождается 200 кДж/ моль. В АТФ запасается 55% энергии, остальная рассеивается в виде тепла.
Анаэробное дыхание. При отсутствии или недостатке кислорода, играющего роль конечного акцептора электронов в кислородном дыхании, цепь передачи электронов через мембрану не осуществляется, а значит, не создается протонный резервуар, обеспечивающий энергией синтез АТФ. В этих условиях клетки способны синтезировать АТФ, расщепляя питательные вещества в процессе анаэробного дыхания. Анаэробное дыхание осуществляют многие виды бактерий, микроскопические грибы и простейшие. Некоторые клетки, временами испытывающие недостаток кислорода (например, мышечные клетки или клетки растений), тоже обладают способностью к анаэробному дыханию.
Анаэробное дыхание — эволюционно более ранняя и энергетически менее рациональная форма получения энергии из питательных веществ по сравнению с кислородным дыханием.
В основе анаэробного дыхания лежит процесс, в ходе которого глюкоза расщепляется до пировиноградной кислоты и высвобождаются атомы водорода. Акцептором атомов водорода, отщепляемых в результате дыхания, является пировиноградная кислота, которая превращается в молочную. Схематически ход анаэробного дыхания можно выразить следующими уравнениями:

Описанный процесс получил название молочнокислого брожения. Суммарно этот процесс можно выразить следующим уравнением:
: 
Молочнокислое брожение осуществляют молочнокислые бактерии (например, кокки из рода стрептококк). Образование молочной кислоты по такому типу происходит также в животных клетках в условиях дефицита кислорода.
В природе широко распространено спиртовое брожение, которое осуществляют дрожжи. В отсутствие кислорода дрожжевые клетки образуют из глюкозы этиловый спирт и СО; . Вначале спиртовое брожение идет аналогично молочнокислому, но последние реакции приводят к образованию этилового спирта. От каждой молекулы пи-ровиноградной кислоты отщепляется молекула С02, и образуется молекула двууглеродного соединения — уксусного альдегида, который затем восстанавливается до этилового спирта атомами водорода:
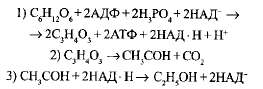
Суммарное уравнение:

Спиртовое брожение, кроме дрожжей, осуществляют некоторые анаэробные бактерии. Этот тип брожения наблюдается в растительных клетках в отсутствие кислорода.
Наиболее распространенным питательным веществом, которое используется для анаэробного высвобождения энергии, является глюкоза. Однако следует помнить, что любое органическое вещество при соответствующих условиях может выступать источником энергии для синтеза АТФ.
При недостатке в клетке глюкозы в дыхание могут вовлекаться жиры и белки. Продуктами брожения являются различные органические кислоты (молочная, масляная, муравьиная, уксусная), спирты (этиловый, бутиловый, амиловый), ацетон, а также углекислый газ и вода.
КРАТКО
Энергетический обмен - выделяется энергия. Распад веществ в клетке до простых, неспецифичных соединений. Начинается в цитоплазме, а заканчивается в митохондриях.
Этапы:
1) Подготовительный - крупные молекулы распадаются на мономеры. Белки до АМК. Углеводы до моносахаров. Жиры до ВЖК. У одноклеточных животных идёт в вакуолях и лизосомах. У многоклеточных животных этот этап проходит в ЖКК с выделением 10% энергии в виде тепла.
2) Безкислородный - происходит гликолиз и молочнокислое брожение. При этом глюкоза в цитоплазме клеток расщепляется до молочной кислоты. При этом высвобождающаяся энергия идет на синтез 2 молекул АТФ. У некоторых микроорганизмов, а иногда и в клетках глюкоза расщепляется до этанола. АМК, ВЖК, глицерин на этом этапе расщепляются до молочной кислоты, а иногда с образованием спирта.
3) Кислородный - универсальный этап, он абсолютно одинаков для распада мономеров с образованием воды и углекислого газа. При расщеплении двух молекул молочной кислоты выделяется энергия, необходимая на синтез 36 молекул АТФ. Происходит в митохондриях. Там есть ферменты и атмосферный кислород. Процесс окисления органических веществ в присутствии кислорода называется тканевым дыханием, или биологическим окислением. Энергия выделяется на этом этапе дискретно. Основная часть энергии идёт на синтез АТФ, а частично рассеивается в виде тепла.
13. Сравнительная характеристика прокариот и эукариот
| Сравнительная характеристика прокариот и эукариот | ||
| Признаки | Прокариоты | Эукариоты |
| Ядерная оболочка | Нет | Есть |
| ДНК | Замкнута в кольцо (условно называется бактериальная хромосома) | Ядерная ДНК представляет собой линейную структуру и находится в хромосомах |
| Хромосомы | Нет | Есть |
| Митоз | Нет | Есть |
| Мейоз | Нет | Есть |
| Гаметы | Нет | Есть |
| Митохондрии | Нет | Есть |
| Пластиды у автотрофов | Нет | Есть |
| Способ поглощения пищи | Адсорбция через клеточную мембрану | Фагоцитоз и пиноцитоз |
| Пищеварительные вакуоли | Нет | Есть |
| Жгутики | Есть | Есть |