
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Общие положения, Классификация
|
|
Адсорбцией называется самопроизвольное изменение концентрации компонента в поверхностном слое по сравнению с его концентрацией в объеме фазы.
Более плотную фазу (определяющую форму поверхности) принято называть адсорбентом, вещество, молекулы которого могут адсорбироваться – адсорбтивом, уже адсорбированное вещество – адсорбатом. Процесс, обратный адсорбции, называют десорбцией.
КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ АДСОРБЦИИ
Для количественного описания адсорбции применяют три величины.
1. Избыточная, или гиббсовская адсорбция (Гi).
Это избыток i-го компонента в поверхностном слое по сравнению с его количеством в объеме фазы, приходящийся на единицу площади поверхности.
 (2.9)
(2.9)
где  и
и  – молярная концентрация i-го компонента соответственно в поверхностном слое и в объеме фазы, V3 – объем поверхностного слоя, который принято считать двухмерным и равным 1 см2, S1, 2 – площадь поверхностного слоя.
– молярная концентрация i-го компонента соответственно в поверхностном слое и в объеме фазы, V3 – объем поверхностного слоя, который принято считать двухмерным и равным 1 см2, S1, 2 – площадь поверхностного слоя.
Учитывая, что молярная концентрация, умноженная на объем, – это количество вещества,
 , моль/дм2 (2.10)
, моль/дм2 (2.10)
2. Абсолютная адсорбция.
В тех случаях, когда способность вещества к адсорбции резко выражена, и вследствие этого  > >
> >  и
и 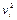 > >
> >  адсорбцию характеризуют величиной Аi, называемой абсолютной адсорбцией.
адсорбцию характеризуют величиной Аi, называемой абсолютной адсорбцией.
 , моль/дм2 (2.11)
, моль/дм2 (2.11)
где  – количество вещества в поверхностном слое
– количество вещества в поверхностном слое
3. Удельная адсорбция.
В тех случаях, когда измерить площадь поверхности S1, 2 трудно, количество i-го компонента  (или его массу
(или его массу  ) относят к массе адсорбента m, используя величину удельной адсорбции
) относят к массе адсорбента m, используя величину удельной адсорбции  :
:
 моль/кг или
моль/кг или  кг/кг. (2.12)
кг/кг. (2.12)
Если адсорбтивом является газ, вместо его количества (моль) или массы (кг) применяют его объем, исходя из того, что при нормальных условиях (0°С, 1 атм) 1 моль любого газа занимает объем, равный 22, 4 дм3. Тогда удельная адсорбция измеряется дм3/кг.
Если Гi, Аi,  > 0, адсорбцию называют положительной (в дальнейшем термином «адсорбция» будем называть именно положительную адсорбцию), если Гi, Аi,
> 0, адсорбцию называют положительной (в дальнейшем термином «адсорбция» будем называть именно положительную адсорбцию), если Гi, Аi,  < 0, то имеет место отрицательная адсорбция.
< 0, то имеет место отрицательная адсорбция.
КЛАССИФИКАЦИЯ АДСОРБЦИОННЫХ ПРОЦЕССОВ
В зависимости от природы адсорбционных сил, адсорбция может быть физической и химической.
Физическая адсорбция обусловлена силами межмолекулярного взаимодействия.
Вы помните, что если молекулы полярны, возникают ориентационное, индукционное и дисперсионное взаимодействия. В случае неполярных молекул возможны только дисперсионные взаимодействия.
Особенности физической адсорбции:
1. Обратимость. Имеет место динамическое равновесие:
Сорбция  Десорбция.
Десорбция.
Десорбция обусловлена тепловым движением. Например, при адсорбции уксусной кислоты на угле на поверхности возникает адсорбционный комплекс:
С + СН3СООН  С * СН3СООН С * СН3СООН
| ||
| адсорбент | адсорбтив | комплекс |
При десорбции комплекс разрушается и адсорбтив выделяется в химически неизменном виде.
2. Малая специфичность. На полярных адсорбентах адсорбируются полярные вещества, на неполярных – неполярные.
3. Незначительная теплота адсорбции (теплота, которая выделяется при адсорбции). Она составляет всего 8 – 40 кДж/моль, т. е. соизмерима с теплотой конденсации.
4. С повышением температуры адсорбция уменьшается: 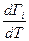 < 0 и. так как увеличивается скорость десорбции.
< 0 и. так как увеличивается скорость десорбции.
Химическая адсорбция (хемосорбция) возникает в результате химической реакции между адсорбтивом и адсорбентом с образованием нового поверхностного соединения. Процесс происходит только на поверхности адсорбента.
Особенности химической адсорбции:
1. Необратимость. При десорбции с поверхности уходит поверхностное соединение. Десорбция обусловлена какими – то внешними воздействиями.
Например, адсорбция кислорода на угле:
С + О2  С * СО2 С * СО2
| ||
| адсорбент | адсорбтив | комплекс |
При нагревании происходит десорбция:
С*О2  С + СО2 С + СО2
| |
| адсорбционный комплекс | новое химическое соединение |
2. Специфичность. Адсорбция происходит, только если возможна химическая реакция.
3. Высокая теплота адсорбции, которая может достигать 800 – 1000 кДж/моль, т. е. сопоставима с тепловыми эффектами химических реакций.
4. Повышение температуры приводит к увеличению хемосорбции, так как увеличивается скорость химического взаимодействия.
 |
В дальнейшем мы будем рассматривать только физическую адсорбцию и поэтому будем ее называть просто адсорбцией (рис. 2.2).
Рис.2.2. Классификация в зависимости от агрегатного состояния адсорбента и адсорбтива.