
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ПРАВИЛО ДЮКЛО-ТРАУБЕ
|
|
Из уравнения Гиббса следует, что характеристикой поведения вещества при адсорбции является величина производной 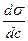 , однако ее значение изменяется при изменении концентрации (см. рис. 3.2). Чтобы придать этой величине вид характеристической постоянной, берут ее предельное значение (при с
, однако ее значение изменяется при изменении концентрации (см. рис. 3.2). Чтобы придать этой величине вид характеристической постоянной, берут ее предельное значение (при с  0). Эту величину П. А. Ребиндер (1924) назвал поверхностной активностью g:
0). Эту величину П. А. Ребиндер (1924) назвал поверхностной активностью g:
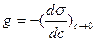 (3.4)
(3.4)
[g] = Дж – м3/м2-моль = Дж – м/моль или Н-м2/моль.
Чем в большей степени уменьшается поверхностное натяжение с увеличением концентрации адсорбируемого вещества, тем больше поверхностная активность этого вещества, и тем больше его гиббсовская адсорбция.
Поверхностную активность можно определить графически как отрицательное значение тангенса угла наклона касательной, проведенной к кривой  =f(c) в точке ее пересечения с осью ординат.
=f(c) в точке ее пересечения с осью ординат.
Таким образом, для ПАВ: g > 0; 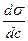 < 0, Гi > 0. Для ПИВ: g < 0;
< 0, Гi > 0. Для ПИВ: g < 0; 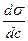 > 0, Гi< 0.
> 0, Гi< 0.
Было установлено следующее.
1. Поверхностная активность (g) возрастает с уменьшением полярности вещества. Поэтому поверхностная активность органических кислот больше величины g для их солей, например:

Этим же объясняется инактивность сахарозы, молекула которой наряду с неполярным углеводородным каркасом имеет много полярных групп, поэтому в молекуле имеется баланс полярной и неполярной части.
2. В гомологическом ряду прослеживаются четкие закономерности в изменении поверхностной активности (g): она возрастает по мере увеличения длины углеводородного радикала.
На основании большого экспериментального материала в конце XIX в. Дюкло и Траубе сформулировали правило:
Поверхностная активность предельных жирных кислот в водных растворах возрастает в 3 – 3, 5 раза при удлинении углеводородной цепи на одно звено (группу –CH2).
На рис. 3.4 приведены изотермы поверхностного натяжения для ряда кислот.

Рис.3.4. Изотерма поверхностного натяжения некоторых кислот
1 – СН3СООН – уксусная кислота (nс=1); 2 – СН3СН2СООН – пропионовая кислота (nс =2); 3 – СН3(СН2)2СООН – масляная кислота (nс =3); 4 – СН3(СН2)3СООН – изовалериановая кислота (nс = 4); 5 – СН3(СН2)4СООН – капроновая кислота (nс =5); nс – число атомтов С в углеводородном радикале.
Итак, g1< g2< g3< g4< g5. Вы помните, что, зная  =f(c), можно построить изотерму гиббсовской адсорбции Гi = f(с). На рис. 3.5 представлены изотермы адсорбции для пяти рассматриваемых кислот.
=f(c), можно построить изотерму гиббсовской адсорбции Гi = f(с). На рис. 3.5 представлены изотермы адсорбции для пяти рассматриваемых кислот.

Рис.3.4. Изотерма адсорбции кислот
Анализ изотерм адсорбции выявляет следующие закономерности:
g1< g2< g3< g4< g5

То, что Гi (во всех случаях стремится к  , объяснимо, так как адсорбция мономолекулярна. Но чем можно объяснить, что максимальная адсорбция внутри гомологического ряда
, объяснимо, так как адсорбция мономолекулярна. Но чем можно объяснить, что максимальная адсорбция внутри гомологического ряда  не зависит от длины углеводородного радикала? Вероятно, только строго определенным расположением молекул в поверхностном слое.
не зависит от длины углеводородного радикала? Вероятно, только строго определенным расположением молекул в поверхностном слое.