
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Адсорбции Ленгмюра
|
|
Отметим основные положения этой теории.
1. Адсорбция мономолекулярна.
2. При адсорбции устанавливается динамическое равновесие, которое можно рассматривать как квазихимическое. В условиях равновесия скорости процессов адсорбции и десорбции равны.
Константа адсорбционного равновесия
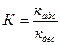 ,
,
где кадс – константа скорости адсорбции; кдес – константа скорости десорбции.
Исходя из данной теории было выведено уравнение, которое мы приводим без вывода:
 (3.15)
(3.15)
где  – максимальная адсорбция ПАВ; Г – адсорбция при концентрации с; К – константа адсорбционного равновесия.
– максимальная адсорбция ПАВ; Г – адсорбция при концентрации с; К – константа адсорбционного равновесия.
Зависимость величины адсорбции от концентрации представлена на рис.3.7.
На кривой четко видны три участка:
I участок – прямая линия, выходящая из начала координат. Действительно, из уравнения Ленгмюра (3.15) при малых концентрациях Кс < < 1, 1 + Кс  1 и
1 и 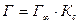 .
.
III участок – соответствует прямой, параллельной оси абсцисс, что означает, что адсорбция достигла своего предельного значения. При этом Кс > > 1 и 1 + Кс  Кс. Следовательно,
Кс. Следовательно, 
II участок – соответствует криволинейной части графика и описывается полным eравнением Ленгмюра (3.15).

Рис.3.7. Зависимость адсорбции от концентрации ПАВ.
Чтобы найти постоянные в уравнении Ленгмюра, его следует привести к линейной форме. Для этого правую и левую части уравнения надо «перевернуть»:
 (3.16)
(3.16)
| с Г |
Умножим обе части уравнения (3.16) на с:
 (3.16)
(3.16)
На рис. 3.8. показан график  .
.
Тангенс угла наклона 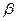 прямой к оси абсцисс
прямой к оси абсцисс

Отрезок, отсекаемый прямой на оси ординат,
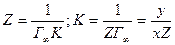
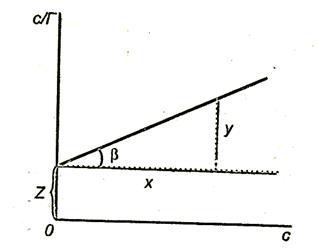
Рис.3.8. Зависимость величины с/Г от концентрации ПАВ.
Доказано, что К в уравнении Шишковского (удельная капиллярная постоянная) и К в уравнении Ленгмюра (константа адсорбционного равновесия) – это одна и та же величина.
Построив график  , можно найти предельную адсорбцию
, можно найти предельную адсорбцию  и константу адсорбционного равновесия К.
и константу адсорбционного равновесия К.
Так как адсорбция рассматривается как псевдохимическая реакция, на основе химической термодинамики можно записать
 (3.18)
(3.18)
где Аmах – работа адсорбции.
Шишковский эмпирическим путем установил, что константа К увеличивается в 3 – 3, 5 раза при удлинении цепи на одно звено –СН2.
Напишем выражение для разности работ адсорбции двух соседних членов гомологического ряда.
 = 8, 31 * 298 * In 3, 5
= 8, 31 * 298 * In 3, 5  3, 2 кДж/моль,
3, 2 кДж/моль,
где n – число атомов углерода в углеводородном радикале.
Это означает, что для перевода каждой – СН2 – группы из поверхностного слоя в объемную фазу надо затратить 3, 2 кДж/моль энергии. Это работа раздвижения диполей воды на величину объема – СН2 – группы – величина аддитивная и одинаковая для различных рядов алифатических предельных соединений. Постоянная разность работ адсорбции для двух соседних членов превращается в постоянное отношение (3 – 3, 5), фигурирующее в правиле Дюкло – Траубе. Сущность этого правила, таким образом, заключается в том, что работа адсорбции на каждую – СН2 – группу является постоянной, близкой к 3, 5 кДж/молъ.
В заключение отметим, что помимо уравнения Гиббса, Шишковского и Ленгмюра существует уравнение Фрумкина, позволяющее рассчитать изменение поверхностного натяжения в результате адсорбции:
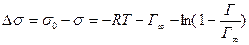 (3.19)
(3.19)