
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Что из себя представляют фазовые диаграммы
|
|
Фазовая диаграмма – это графическое описание составов и относительных количеств фаз в зависимости от химического состава и от внешних условий. В качестве внешних условий может выступать: температура, давление, напряженность магнитного поля, гравитация, химический потенциал вполне подвижного компонента и тд.
Наиболее распространенными являются фазовые диаграммы, показывающие фазовые отношения, возникающие при взаимодействии двух химических элементов в зависимости от температуры. Подобные диаграммы называются двухкомпонентными фазовыми диаграммами в зависимости от температуры или двухкомпонентными Т-х фазовыми диаграммами.
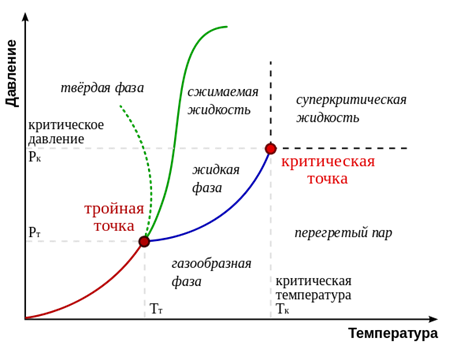
19 Дайте понятие тройной точки на фазовой диаграмме.
Тройна́ я то́ чка в однокомпонентной системе —точка схождения кривых двухфазных равновесий на плоскойфазовой диаграмме, соответствующая устойчивому равновесию трёх фаз. Тройная точка нонвариантна, т. е. не допускает изменения ни одного из параметров состояния — ни температуры, ни давления. Если для индивидуального вещества существует тройная точка, соответствующую состоянию, в котором равновесные фазы находятся в различных агрегатных состояниях (твёрдом, жидком и газообразном), то она единственна, и её называют основной тройной точкой.
В основной тройной точке сходятся три моновариантные линии двухфазных равновесий: плавления (равновесиекристалл — жидкость), кипения (равновесие жидкость —пар) и возгонки (равновесие кристалл — пар). Основная тройная точка не существует для гелия 3Не и 4Не — в обоих случаях линии равновесия твёрдой фазы с жидкими (Не I и Не II) и жидких фаз с газообразной нигде не пересекаются. Другие вещества с такой особенностью неизвестны.
Единственность и нонвариантность основной тройной точки позволяет использовать её как репер температуры. В частности, температурная шкала Кельвина использует тройную точку воды в качестве опорной.
Правило фаз Гиббса ограничивает число сосуществующих фаз — однокомпонентная система в равновесии не может иметь больше трёх фаз, — но не накладывает ограничений на их агрегатное состояние. Поэтому в случае энантиотропии на диаграмме состояния помимо основной тройной точки появляются дополнительные тройные точки отвечающие:
· равновесию двух твёрдых фаз с жидкостью (например, аллотропных модификаций кристаллической серы —ромбическая и моноклинной — и жидкой серы);
· равновесию двух твёрдых фаз с паром;
· равновесию трёх твёрдых фаз.
Возможно также появление метастабильных тройных точек, расположенные на пересечении линий метастабильных двухфазных равновесий (или продолжений этих линий). В случае монотропии появляется только метастабильная тройная точка.
Гелий имеет дополнительные тройные точки. В них сосуществуют либо две жидкие фазы (Не I и Не II) и кристаллический гелий, либо две жидкие фазы и газообразный гелий. Для воды в 1975 г. были известны семь дополнительных тройных точек, из них три — для трёх твёрдых фаз.
При увеличении числа компонентов системы (раствора или сплава) увеличивается и число независимых параметров, характеризующих эту систему. Для описания двухкомпонентной системы к температуре и давлению добавляют третий параметр, характеризующий состав системы. Нонвариантной в бинарной системе будет четверная точка (например, в системе соль — кристаллогидрат соли — водный раствор соли — водяной пар, когда газовая, жидкая и две твёрдые фазы находятся в равновесии). Трёхмерная диаграмма состояния бинарной системы имеет уже множество тройных точек, расположенных на тройной пространственной кривой. На плоской диаграмме равновесие трёх фаз для такой системы можно отобразить, если считать один из параметров постоянным. В общем случае тройные точки существуют на плоских диаграммах состояния систем с любым числом компонентов, если все параметры, определяющие состояние системы, кроме двух, фиксированы.
В трёхкомпонентной системе тройной точкой называют нонвариантную точку четырёхфазного равновесия расплава с тремя твёрдыми фазами (тройная эвтектическая точка, точка тройной эвтектики).
20 Является ли фаза химическим соединением?
Фазой называется часть или совокупность гомогенных частей системы, разделённых границами раздела, обладающие одинаковым составом, структурой, свойствами и при переходе через границу раздела структуры, состав, свойства или структура могут меняться скачкообразно.
Графическим способом описания фаз, находящихся в состоянии равновесия, является диаграмма состояния.
Наиболее простым типом химических соединений являются соединения с нормальной валентностью, которые образуются при взаимодействии типичных металлов и элементов, обладающих и металлическими, и неметаллическими свойствами. Часто химические соединения относят к промежуточным фазам.
Характерными особенностями соединений с нормальной валентностью являются:
–постоянство состава или очень узкие области гомогенности;
–состав описывается стехиометрическими формулами, подчиняющимися правилам химической валентности (MgSi, MgSb2, MgTe);
–наличие нового типа решетки, отличного от типа решеток компонентов, образующих это соединение;
–ярко выраженные индивидуальные свойства;
–постоянство температуры кристаллизации.
К химическим соединениям с нормальной валентностью примыкает большая группа полупроводниковых соединений, образованных элементами IVB – VIIB подгрупп таблицы Менделеева. Фазы, объединенные в отдельные группы, имеют одинаковый стехиометрический состав и образованы элементами из одинаковых подгрупп.
Полупроводниковые соединения характеризуются большим разнообразием кристаллических структур и могут быть постоянного и переменного состава.
21 Что такое твердые растворы?
Твердыми растворами называются такие фазы, в которых атомы одного или нескольких компонентов располагаются в кристаллической решетке другого, не изменяя ее типа. Компонент, решетка которого сохраняется, называется растворителем, а остальные – примесью или растворенными элементами. В зависимости от того как располагаются атомы примеси в решетке растворителя, различают три типа твердых растворов: замещения, внедрения и вычитания.
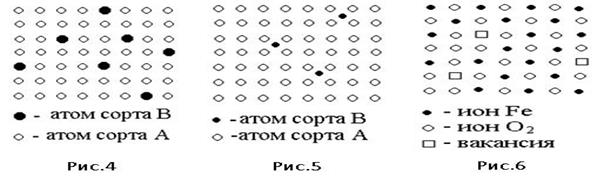
В твердых растворах замещения атомы растворенного элемента замещают атомы растворителя в узлах кристаллической решетки, распределяясь, чаще всего, хаотически (рис.4) При этом растворителем может быть химический элемент (металл), а также химическое соединение. В твердых растворах между химическими соединениями ионы одного сорта замещаются ионами другого сорта в соответствии со схемой (рис 4), например, в системе NaCl – KCl ионы калия замещают ионы натрия.
В твердых растворах внедрения атомы примеси располагаются в междоузлиях кристаллической решетки растворителя (рис.5). Растворы типа внедрения чаще всего образуются при растворении элементов с малыми атомными радиусами (водород, углерод, азот, бор и др.) в металлах переходной группы (например, раствор углерода в железе). Положение атома внедрения в междоузлии устойчиво, если радиус внедренного атома достаточно мал, чтобы не слишком смещать окружающие его атомы металла, и достаточно велик, чтобы с ними соприкасаться. Растворы этого типа существуют и на базе химических соединений (раствор никеля в NiSb).
Твердые растворы вычитания (растворы с дефектной решеткой) образуются на основе химических соединений. Типичным примером является раствор кислорода в соединении FeO (рис.6). Все позиции, в которых должны находиться ионы кислорода, заняты, а часть позиций, которые должны быть заняты ионами железа, – вакантны. Дефектной может быть как металлическая подрешетка, так и неметаллическая, например в оксидах титана, содержащих от 38 до 56 атомных процентов кислорода. В кристаллах с максимальным содержанием титана (TiO0, 6) все дефекты находятся в кислородной подрешетке, с уменьшением содержания титана уменьшается общее число дефектов, и они распределяются между обеими подрешетками. У оксида с максимальным содержанием кислорода все дефекты находятся в титановой подрешетке.
Характерной особенностью растворов типа вычитания является наличие металлических ионов разной валентности.
Следует отметить, что независимо от типа твердого раствора, все они имеют атомарный характер, т.е. в узлах кристаллической решетки располагаются атомы или ионы, но не молекулы.
Твердые растворы, однородные (гомогенные) крис-таллич. фазы переменного состава; образуются в двойных или многокомпонентных системах. Если компоненты системы неограниченно р-римы друг в друге, они образуют непрерывный ряд твердых растворов. Чаще, однако, концентрация растворенного в-ва не может превышать нек-рое предельное значение и существование твердого раствора ограничено нек-рыми областями составов (области гомогенности). Твердыми растворами являются мн. металлич. сплавы и неметаллич. системы - минералы, стекла, полупроводники, ферриты.
22 Охарактеризуйте типы твердых растворов
23 Что из себя представляют твердые растворы внедрения, замещения и вычитания?
Различают три вида твердых растворов: - твердые растворы замещения; - твердые растворы внедрения; - твердые растворы вычитания.
Твёрдые растворы — основа всех важнейших конструкционных и нержавеющих сталей, бронз, латуней, алюминиевых и магниевых сплавов высокой прочности. Легированные полупроводники, являющиеся основой современной твердотельной электроники, также являются твердыми растворами.