
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Энергетический спектр атома.
|
|
Одним из недостатков полуклассической теории Бора была полная неприменимость к атомам, более сложным, чем атом водорода. Ни атом гелия, ни другие атомы, ни простейшие молекулы не имеют энергетических спектров, похожих на спектр (а.1.4). Вначале провели экспериментальную классификацию спектров сложных атомов. Были обнаружены закономерности, позволившие выделить спектральные серии, объединяющие разрешенные переходы в определенные группы. Серии получили специфические обозначения s, p, d, f (сокращенные обозначения названий sharp, principal, diffuse, fundamental, то есть резкая, главная, диффузная, фундаментальная серия). Эти серии относятся, как было выяснено позже, к состояниям с различными значениями момента импульса. Момент импульса в данном случае принято называть орбитальным моментом и обозначать квантовым числом  . Допустимые значения
. Допустимые значения  равны
равны 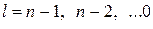 , где
, где  – главное квантовое число, появившееся в формулах (а.1.3), (а.1.4). Было установлено также, что переходы с испусканием или поглощением фотонов разрешены только в тех случаях, когда изменение орбитального момента происходит на единицу,
– главное квантовое число, появившееся в формулах (а.1.3), (а.1.4). Было установлено также, что переходы с испусканием или поглощением фотонов разрешены только в тех случаях, когда изменение орбитального момента происходит на единицу,
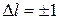 . (а.2.1)
. (а.2.1)
Самое нижнее энергетическое состояние атома называется основным, остальные – это возбужденные состояния. Имеются возбужденные состояния, в которых электрон находится заметно большее время, чем в обычных возбужденных состояниях. Такие состояния называются метастабильными. Они могут распадаться, например, с одновременным испусканием двух фотонов, или при столкновении возбужденного атома с другим атомом.
Система как целое имеет три степени свободы. В квантовой механике этому соответствует требование указывать для описания состояния системы три квантовых числа. Обычно это главное квантовое число  , орбитальное или азимутальное квантовое число
, орбитальное или азимутальное квантовое число  и магнитное квантовое число
и магнитное квантовое число 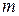 (оно играет важную роль в теории эффекта Зеемана). Четвертое квантовое число не имеет классического аналога и называется спиновым квантовым числом
(оно играет важную роль в теории эффекта Зеемана). Четвертое квантовое число не имеет классического аналога и называется спиновым квантовым числом 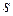 . Необходимо отметить, что можно использовать и другие комбинации квантовых чисел, но смысл чисел
. Необходимо отметить, что можно использовать и другие комбинации квантовых чисел, но смысл чисел 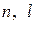 обычно сохраняется.
обычно сохраняется.
Приведем таблицу возможных значений квантовых чисел и структуру электронных оболочек (эта таблица поясняет, в частности, формирование таблицы элементов Менделеева)

|  0 1 2 3 … 0 1 2 3 …
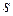 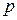  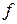 … …
| Максимальное число электронов | Обозначение слоя (оболочки) |
| K | |||
| 2 + 6 | L | ||
| 2 + 6 + 10 | M | ||
| 2 + 6 + 10 + 14 | N | ||
| … | ………………… | … | … |
Сложная структура энергетического спектра атома экспериментально продемонстрирована в опытах Франка и Герца. Опыты проводились в вакуумном триоде, в который было добавлено небольшое количество исследуемого газа (в оригинальных опытах использовались пары ртути). При приложении к катоду и сетке ускоряющего напряжения в лампе возникал анодный ток. Пока напряжение было невелико, ток увеличивался с ростом напряжения. Но при некотором значении (измеряется экспериментально) напряжения электроны разгонялись до таких кинетических энергий, что, соударяясь с атомами ртути, они были в состоянии возбудить атом, отдав ему свою энергию. После неупругих соударений электроны двигались медленно, так что ток, создаваемый этими электронами, резко уменьшался. Затем наблюдался новый монотонный рост тока – до следующего неупругого столкновения. Когда удалось рассчитать энергетический спектр ртути оказалось, что опыты Франка и Герца не только подтверждают дискретность спектра сложного атома, но и дают хорошее количественное согласие теории и эксперимента.
Как же проводится теоретическое описание сложных атомов, содержащих два или более электронов? Используется стационарное уравнение Шредингера
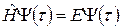 (а.2.2.)
(а.2.2.)
где  - совокупность координат частиц, составляющих атом, а оператор Гамильтона имеет вид
- совокупность координат частиц, составляющих атом, а оператор Гамильтона имеет вид
 . (а.2.3)
. (а.2.3)
Первое слагаемое представляет собой оператор кинетической энергии всех электронов (их в атоме  ,
, 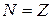 ,
,  – заряд ядра), то есть
– заряд ядра), то есть
 . (а.2.4)
. (а.2.4)
Вторая частная производная берется по радиус-вектору i – го электрона 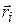 , который соединяет ядро и этот электрон; другое обозначение этой производной – квадрат оператора набла или оператор Лапласа.
, который соединяет ядро и этот электрон; другое обозначение этой производной – квадрат оператора набла или оператор Лапласа.
Ядро предполагается неподвижным (его движение приводит к уширению линий), хотя при более строгом описании гамильтонианы (а.2.3) надо рассматривать относительно неподвижного центра масс атома.
Оператор потенциальной энергии  состоит из двух частей – потенциальной энергии отталкивания (положительная часть) электронов, и потенциальной энергии притяжения электронов к ядру,
состоит из двух частей – потенциальной энергии отталкивания (положительная часть) электронов, и потенциальной энергии притяжения электронов к ядру,
 , (а.2.5)
, (а.2.5)
 . (а.2.6)
. (а.2.6)
Легко заметить, что формулы (5) и (6) изображают кулоновские потенциальные энергии соответствующих частей атома.
Мы видим, что уравнение Шредингера представляет собой сложное дифференциальное уравнение второго порядка с переменными коэффициентами. Найти его точное аналитическое решение до сих пор не удалось (да, наверно, и не удастся). Для получения решения используют три основных метода приближенных решений. Активно используется вычислительная техника, хотя и компьютерные методы дают лишь приближенные результаты (это, чаще всего, подход квантовой химии). Второй метод – использование вариационных методов. Эти очень мощные методы применимы ко многим задачам квантовой механики. Они интересны тем, что позволяют использовать любую информацию о решении, включая интуитивные представления о системе, экспериментальные данные и др. Но это все же приближенные решения. Третий метод наиболее распространен. Имеется в виду теория возмущений. Первые её разновидности появились еще при описании совместного движения небесных тел, например, движения Луны под воздействием Земли (основное влияние) и Солнца (возмущение). Суть метода в том, что, сформулировав полную задачу (скажем, указав уравнение Шредингера (2)), выбирают такую ее часть, решение которой известно. Это может быть, например, задача (2) – (6), но без оператора потенциальной энергии (5), учитывающего взаимодействие электронов друг с другом. Тогда получается задача, несколько напоминающая задачу об атоме водорода. Решив такую задачу, получают волновые функции  и значения энергии
и значения энергии 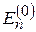 , весьма напоминающие выражения для атома водорода. Предсказания, сделанные с помощью
, весьма напоминающие выражения для атома водорода. Предсказания, сделанные с помощью  и
и 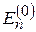 не совпадают с экспериментальными данными и их надо улучшить, учтя (5). С этой целью к
не совпадают с экспериментальными данными и их надо улучшить, учтя (5). С этой целью к  прибавляется функция
прибавляется функция 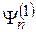 , о которой заранее известно, что
, о которой заранее известно, что 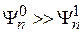 . Сумма функций подставляется в задачу (2) – (6), причем часть особо малых слагаемых пропадает. Это уравнение можно решить относительно
. Сумма функций подставляется в задачу (2) – (6), причем часть особо малых слагаемых пропадает. Это уравнение можно решить относительно 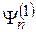 и получить поправки к энергиям
и получить поправки к энергиям 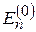 , которые становятся ближе к наблюдаемым результатам. Затем берут вторую добавочную функцию и повторяют процедуру решения. В идеале, после многих шагов дающих сходящийся ряд волновых функций, можно получить достаточно точное решение исходного уравнения.
, которые становятся ближе к наблюдаемым результатам. Затем берут вторую добавочную функцию и повторяют процедуру решения. В идеале, после многих шагов дающих сходящийся ряд волновых функций, можно получить достаточно точное решение исходного уравнения.
Несколько замечаний.
1. Большинство квантовомеханических задач решают именно с помощью теории возмущений.
2. Не всегда указанная выше примитивная форма теории возмущений дает приемлемые результаты. Например, при описании многоэлектронных атомов приходится рассматривать более сложные схемы решения.
3. Некоторые физические задачи нельзя решить в рамках теории возмущений в принципе. Это, например, задач о бозе конденсации (сверхпроводимости или сверхтекучести).
4. Метод теории возмущений заслуживает самого внимательного отношения, поскольку он позволяет давать описание не только физических задач, но также сложных экономических, психологических и других «гуманитарных» задач. В частности, в рамках сравнительно новой науки синергетики теория возмущений позволяет наметить решения межличностных взаимоотношений в достаточно больших коллективах (ансамблях).
Для большого числа электронов N теория возмущений не работает. Тогда используют другие методы. Это построение модельных гамильтонианов, которые отличаются от «истинных», но позволяют решить задачу. К ним можно отнести метод Хартри и метод Томаса – Ферми, обсуждение которых выпадает из курса ФОПИ.
Дополнительные сложности создает наличие у электронов собственного механического момента (спина); потенциальные энергии, связанные со спиновыми взаимодействиями вообще не были указаны в исходном операторе Гамильтона (3) – (6). Более тонкие особенности энергетического спектра атома (даже атома водорода) требуют учета релятивистских поправок, детально рассмотренных Дираком и Паули.
С наличием спина связаны очень важные особенности энергетического спектра атомов. Рассмотрим эти особенности более подробно.
Пусть имеется атом водорода с одним электроном. Спин электрона может быть направлен либо «вверх», либо «вниз» – по отношению к произвольно выбранной оси, называемой осью квантования (при наличии магнитного поля ось квантования направляется по магнитному полю). Свойства таких «ориентированных» атомов водорода одинаковы, но в молекулу объединяются атомы с противоположной ориентацией спинов. В принципе возможна химическая связь атомов водорода с параллельными спинами, но у них энергия основного состояния выше.
Рассмотрим теперь атом гелия, имеющего два электрона. Эти электроны «движутся по одной и той же орбите», то есть имеют одно и то же главное квантовое число  . Согласно принципу Паули, их состояния должны быть различны (в одном квантовом состоянии может находиться только один фермион; или не быть ни одного фермиона). Различие связано с направлением спинов. Поместить третий электрон на ту же орбиту нельзя – все состояния заняты. Говорят, что у гелия «оболочка», соответствующая орбите
. Согласно принципу Паули, их состояния должны быть различны (в одном квантовом состоянии может находиться только один фермион; или не быть ни одного фермиона). Различие связано с направлением спинов. Поместить третий электрон на ту же орбиту нельзя – все состояния заняты. Говорят, что у гелия «оболочка», соответствующая орбите 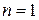 , заполнена.
, заполнена.
У атома с 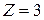 , т.е. у лития, имеется три электрона. Поскольку оболочка
, т.е. у лития, имеется три электрона. Поскольку оболочка 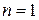 заполнена, начинает заполняться следующая оболочка,
заполнена, начинает заполняться следующая оболочка, 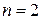 . С учетом влияния спина и запрета Паули в этом атоме находятся два s – электрона и один электрон с произвольным спином в состоянии p. Согласно принципу Паули всего на оболочке
. С учетом влияния спина и запрета Паули в этом атоме находятся два s – электрона и один электрон с произвольным спином в состоянии p. Согласно принципу Паули всего на оболочке 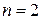 могут находиться два s – электронов (как у гелия) и шесть p – электронов (см. о s, p, d … оболочках и их связи с орбитальным моментом
могут находиться два s – электронов (как у гелия) и шесть p – электронов (см. о s, p, d … оболочках и их связи с орбитальным моментом  выше, перед формулой (а.2.1)).
выше, перед формулой (а.2.1)).
Поочередное добавление электронов (переход к атомам Be, B, C, N, O, Ne) приводит к постепенному заполнению этой оболочки. Дальнейшее «внедрение» электронов на оболочку 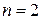 запрещено принципом Паули, так что начинается заполнение следующей оболочки
запрещено принципом Паули, так что начинается заполнение следующей оболочки 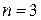 . Это атомы Na, Mg, Al, и так далее до аргона Ar (в этой группе тоже восемь различных состояний электронов и, соответственно, восемь атомов). Дальше происходит заполнение оболочки
. Это атомы Na, Mg, Al, и так далее до аргона Ar (в этой группе тоже восемь различных состояний электронов и, соответственно, восемь атомов). Дальше происходит заполнение оболочки  , где оказывается восемнадцать различных состояний и т.д. Таким образом, представление о квантовых числах, характеризующих энергетический спектр атома, вместе с принципом Паули дает теоретическое объяснение структуры периодической таблицы элементом Д.И. Менделеева. Приходится отмечать, что в западной литературе существуют двойные стандарты. Там охотно цитируются работы и указываются достижения «своих» ученых и несколько замалчиваются успехи «чужих» (это относится не только к России). Во всяком случае, в англоязычной литературе не всегда связывают таблицу элементов с именем Менделеева. Более того, иногда в связи с таблицей элементов упоминают фамилию Г. Сиборга.
, где оказывается восемнадцать различных состояний и т.д. Таким образом, представление о квантовых числах, характеризующих энергетический спектр атома, вместе с принципом Паули дает теоретическое объяснение структуры периодической таблицы элементом Д.И. Менделеева. Приходится отмечать, что в западной литературе существуют двойные стандарты. Там охотно цитируются работы и указываются достижения «своих» ученых и несколько замалчиваются успехи «чужих» (это относится не только к России). Во всяком случае, в англоязычной литературе не всегда связывают таблицу элементов с именем Менделеева. Более того, иногда в связи с таблицей элементов упоминают фамилию Г. Сиборга.
Укажем несколько характерных особенностей заполнения электронных оболочек у тяжелых атомов.
1. При увеличении  или
или  взаимодействия между ядром и электронами усложняется, возникают различные дополнительные эффекты (например, экранировка ядра электронами внутренних оболочек), что приводит к нарушению плавного характера заполнения оболочек. В результате выделяются аномальные группы элементов, например, «редкие земли» первой (Z = 58 – 71) и второй (Z > 89) групп.
взаимодействия между ядром и электронами усложняется, возникают различные дополнительные эффекты (например, экранировка ядра электронами внутренних оболочек), что приводит к нарушению плавного характера заполнения оболочек. В результате выделяются аномальные группы элементов, например, «редкие земли» первой (Z = 58 – 71) и второй (Z > 89) групп.
2. При заполнении оболочек электроны испытывают различные силы притяжения к ядру. Это означает, что различны энергии их связи с атомом. Это обстоятельство определяет, к какому типу веществ относится атом данного типа – к металлам или «металлоидам». Это же обстоятельство определяет химическую активность различных атомов. Один электрон на внешней оболочке слабо связан и легко отрывается от атома, обеспечивая атому возможность вступить в химическую реакцию. Наоборот, одно свободное место (почти заполненная внешняя оболочка) легко захватывает лишний электрон, что так же делает атом химически активным.
3. Атомы с полностью заполненными оболочками химически пассивны и относятся к классу «благородных газов». Долгое время считалось, что они вообще не вступают в химические реакции. Оказалось, что это не совсем так. Например, возбужденный гелий, у которого оболочки перестают быть заполненными, может вступать в химическую реакцию с галогенами (хлор и т.п.). Некоторые соединения такого типа быстро распадаются с выделением энергии в виде кванта света. Такие соединения используются как активные среды в эксимерных лазерах.
Надо заметить, что самые лучшие теоретические результаты, полученные для изолированного многоэлектронного атома, отличаются от экспериментальных результатов. Кроме перечисленных причин к этому приводят различные взаимодействия атомов с окружающей средой – другими атомами и электромагнитными полями. Из-за движения и столкновений атомов их состояния перестают быть стационарными. Экспериментально это приводит к уширению энергетических уровней (размытию собственных значений энергии электронов в атоме). Обратите внимание на то, что в подтвержденной квантовомеханическими методами теории водорода Бора, уровни имеют строго определенную энергию, то есть бесконечно узки. Но эксперименты и более строгие теории показывают наличие конечной ширины энергетических уровней атомов. Движение атомов и их столкновения приводят к двум типам уширения – доплеровскому, имеющему индивидуальную природу и столкновительному, явлению коллективному. Кроме механических (контактных) взаимодействий к уширению уровней приводят также электрические и магнитные поля, созданные соседними атомами. Более того, электромагнитное воздействие влияет даже на изолированный атом и в том случае, когда, казалось бы, никаких электромагнитных полей нет. Фотоны электромагнитного поля являются бозонами, у которых минимальная энергия равна 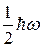 . Поэтому всегда имеется вакуумное электромагнитное поле, смещающее и уширяющее энергетические уровни атома. В 1947 году Лэмб и Ризерфорд экспериментально показали, что вакуумное поле действительно сдвигает энергетические уровни. Для водорода этот сдвиг составил примерно 1 ГГц. Не такая уж большая величина, но позже за открытие Лембовского сдвига была присуждена Нобелевская премия.
. Поэтому всегда имеется вакуумное электромагнитное поле, смещающее и уширяющее энергетические уровни атома. В 1947 году Лэмб и Ризерфорд экспериментально показали, что вакуумное поле действительно сдвигает энергетические уровни. Для водорода этот сдвиг составил примерно 1 ГГц. Не такая уж большая величина, но позже за открытие Лембовского сдвига была присуждена Нобелевская премия.
Завершая этот раздел, отметим, что дискретные энергетические уровни атомов и любых других физических систем (величайшее достижение – идея квантования непрерывной в классической физике величины – энергии) в действительности не существуют. Дело в том, что дискретность уровней возникает только при теоретическом изучении стационарных систем. Но атом, электроны которого переходят с уровня на уровень, испускают или поглощают фотоны, нельзя считать стационарной системой. Поэтому, в силу принципа неопределенности для времени и энергии, каждый уровень приобретает некоторую ширину
 , (а.2.7)
, (а.2.7)
где  – время пребывания электрона на данном уровне.
– время пребывания электрона на данном уровне.
Математическая обработка утверждения (7) показывает, что у атома имеется только один бесконечно узкий или дискретный уровень – основное состояние (идея и работы академика Я.Б.Зельдовича). К нему примыкает непрерывный спектр энергий, представляющий собой наложение всех уширенных возбужденных уровней.
Сделанное утверждение может показаться странным – достаточно узкие или резкие спектральные линии наблюдаются экспериментально. Однако в действительности здесь нет противоречия. Квантовая механика по своей сути является вероятностной наукой. Это означает, что мы с большой вероятностью наблюдаем переходы из «центральных» частей уширенных уровней, с меньшей вероятностью из областей, сдвинутых от центра на 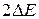 , и практически никогда не наблюдаем переходов из «запрещенных» областей между стационарными уровнями.
, и практически никогда не наблюдаем переходов из «запрещенных» областей между стационарными уровнями.