
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Растворы. 1. Укажите вещества по точной навеске которых можно приготовить стандартный раствор (несколько вариантов):
|
|
Общие
1. Укажите вещества по точной навеске которых можно приготовить стандартный раствор (несколько вариантов):
1. CH3COOH
2. NaOH
3. HCl 
4. H2C2O4·2H2O
5. K2Cr2O7
6. MgSO4
2. Укажите соответствие между титриметрическим методом анализа и координатами кривой титрования
1. Осадительное титрование
2. Комплексонометрия
3. Кислотно-основное титрование
4. Редоксиметрия
5. рН - Vтитранта
6. Е - Vтитранта
7. рМе - Vтитранта
8. рCl - Vтитранта
3. Укажите соответствие между титриметрическим методом анализа и реакцией, находящейся в его основе:
1. Кислотно-основной
2. Редоксиметрический
3. Комплексонометрический
4. Осадительный
1. Ме2++Cl-= МеCl↓
2. Red1+Ox2=Ox1+ Red2
3. Ме2++Na2H2R=Na2МеR+2H+
4. H++OH  =H2О
=H2О
4. Точка эквивалентности – это такой момент в процессе титрования, когда:
1. Индикатор поменял окраску;
2. Титрант и титруемое вещество прореагировали между собой в эквивалентных количествах;
3. Вещества прореагировали между собой в равных количествах;
4. Число моль – эквивалентов титранта и титруемого вещества обратно пропорционально;
5. В основе титриметрического анализа находится закон
1. Постоянства состава
2. Действующих масс
3. Эквивалентов
4. Авагадро
6. Соответствие метода, индикатора и изменения цвета титруемого раствора при фиксировании точки эквивалентности:
| 1. Алкалиметрия | 1. Эриохромовый черный Т | 1. Желтый – оранжевый | ||
| 2. Комплексонометрия | 2. Метиловый оранжевый | 2. Бесцветный – розовый | ||
| 3. Иодометрия | 3. Безиндикаторное титрование | 3. Голубой – бесцветный | ||
| 4. Метод Мора | 4. Крахмал | 4. Бесцветный – розовый | ||
| 5. Ацидиметрия | 5. Фенолфталеин | 5. Винно-красный – синий |
7. Соответствие метода, титранта и стандартного вещества:
| 6. Алкалиметрия | 6. HCl | 6. K2Cr2O7 | ||
| 7. Комплексонометрия | 7. NaOH | 7. K2CrO4 | ||
| 8. Иодометрия | 8. AgNO3 | 8. Na2B4O7 | ||
| 9. Метод Мора | 9. Na2S2O3 | 9. H2C2O4 | ||
| 10. Ацидиметрия | 10. Na2H2Y | 10. NaCl |
8. На величину скачка кривой титрования влияет:
1. рТ индикатора;
2. интервал перехода индикатора;
3. концентрации анализируемого раствора и титранта;
4. объем титранта;
Растворы
1. При разбавлении ацетатного буферного раствора значение величины рН…….
1. увеличится в 2 раза
2. уменьшится в 2 раза
3. уменьшится на 2
4. не изменяется
2. Масса кристаллогидрата (Na2CO3 10Н2О), необходимая для приготовления 500 г раствора карбоната натрия с массовой долей растворенного вещества 10, 6%, составляет _________ г.
1. 286
2. 106
3. 143
4. 212
3. Масса медного купороса, необходимая для приготовления 500 г раствора с массовой долей сульфата меди 16% равна….
(В задаче ссылки на это нет, но надо учитывать, что медный купорос – это кристаллогидрат сульфата меди СuSO4 · 5H2O)
4. Масса медного купороса, необходимая для приготовления 2 л 0, 1 М раствора сульфата меди (II), составляет ________ г.
1. 32
2. 50
3. 25
4. 16
(В задаче ссылки на это нет, но надо учитывать, что медный купорос – это кристаллогидрат сульфата меди СuSO4 · 5H2O)
5. Раствор гидроксида бария массой 200 г и массовой долей растворенного вещества 17, 1 % разбавили водой до объема 400 мл. Молярная концентрация эквивалентов Ва(ОН)2 в полученном растворе составляет ________ моль/л.
1. 2
2. 0, 1
3. 0, 5
4. 1
6. Растворимость оксалата кальция CaC2O4 понизится при добавлении в насыщенный раствор
1. H2O 3. KCl
2. H2C2O4 4. KNO3
7. Растворимость сульфата бария повысится при добавлении в насыщенный раствор
1. H2O 3. KCl
2. H2SO4 4. KNO 3
8. Растворимость сульфата бария понизится при добавлении в насыщенный раствор
1. H2O 3. KCl
2. H2SO4 4. KNO 3
9. Точную мерную посуду применяют для … (несколько ответов):
| 1. приготовления рабочих растворов |
| 2. приготовления стандартных растворов |
| 3. отбора пробы исследуемого раствора |
| 4. добавления растворов индикаторов |
| 5. измерения объема растворов титрантов |
10. Укажите весы и мерную посуду для приготовления стандартного раствора.
1. Технические весы, мерный цилиндр.
2. Аналитические весы, мерный цилиндр.
3. Аналитические весы, мерная колба.
4. Технические весы, мерная колба.
11. Укажите ошибки при работе с пипеткой (несколько ответов):
1. Отмыли от жира
2. Ополоснули титрантом
3. Выдули оставшуюся в ней каплю жидкости
4. По окончании работы промыли и поставили в штатив
12. Укажите ошибку при подготовке бюретки к работе
1. Закрепили в штативе
2. Ополоснули анализируемым раствором
3. «Носик» бюретки заполнили титрантом
4. Объем титранта установили на нулевой отметке
13. Рассчитайте навеску (m, г) NaCl, необходимую для приготовления 500 см3 0, 1 моль/дм3 раствора.
14. Рассчитайте массу навески вещества (г), необходимую для приготовления 1 дм3 раствора с титром 0, 00100 г/см3.
| 1. 0, 1000. | 3. 10, 0000. |
| 2. 1, 0000. | 4. 0, 01000. |
15. Для разбавления 20 см3 0, 1 моль/дм3 раствора H2C2O4 в 10 раз следует взять мерную колбу вместимостью (см3):
1. 50 3. 250
2. 100 4. 200
16. Рассчитайте титр раствора щавелевой кислоты с молярной концентрацией эквивалента 0, 05 моль/дм3.
17. Молярная концентрация (моль/дм3) раствора HCl с титром 0, 003650 г/см3 составляет
1. 0, 05 3. 0, 01
2. 0, 1 4. 0, 02
18. Укажите вместимость (см3) мерной колбы для приготовления из фиксанала. раствора I2 с молярной концентрацией эквивалента 0, 05 моль/дм3.
| 1. 200. | 3. 50. |
| 2. 2000. | 4. 1000. |
19. Для разбавления 20, 0 см3, 0, 1 моль/дм3 раствора комплексона III в 10 раз следует взять колбу вместимостью (см3):
1. 50
2. 100
3. 200
4. 500
20. Для отбора пробы анализируемого раствора используют
1. Бюретку 3. Капельную пипетку
2. Пипетку Мора 4. Мензурку
21. Какой объем воды (см3) необходимо добавить к 20 см3 0, 1 моль/дм3 раствора уксусной кислоты, чтобы получить 0, 05 моль/дм3 раствор?
| 17. 10. | 19. 15. |
| 18. 20. | 20. 40. |
22. Посуда, которая ополаскивается перед титрованием титруемым раствором
| 1. мерная колба. | 4. мерная пипетка. |
| 2. колба для титрования. | 5. мерный цилиндр. |
| 3. бюретка. | 6. химический стакан |
23. Титр это концентрация, показывающая сколько…
13. …миллиграммов вещества, содержащееся в 1 дм3 раствора.
14.... граммов вещества, содержащееся в 1 дм3 раствора.
15. …граммов вещества, содержащееся в 1 см3 раствора.
16. …граммов вещества, содержащееся в 100 г раствора.
24. Рассчитайте титр (г/см3) раствора безводной щавелевой кислоты с молярной концентрацией эквивалента 0, 0100 моль/дм3.
| 25. 4, 5·10–2. | 27. 9, 0·10–3. |
| 26. 4, 5·10–4. | 28. 9, 0·10–4. |
25. Способ приготовления стандартного раствора:
Необходимый объем концентрированного раствора гидроксида натрия
1. отмерить мерным цилиндром, поместить в мерную колбу и довести раствор до метки дистиллированной водой.
2. мерной пробиркой перенести в мерный цилиндр и добавить дистиллированную воду до требуемого объема.
3. пипеткой перенести в мерную колбу и довести объем раствора до метки дистиллированной водой.
4. пипеткой перенести в мерный цилиндр и добавить дистиллированную воду до требуемого объема.
26. Какова молярная концентрация раствора гидроксида калия, полученного смешением 20 см3 раствора КОН с молярной концентрацией 0, 2 моль/дм3 и 230 см3 воды.
27. Для поддержания рН > 9 применяется буферная смесь:
1. CH3COOH + CH3COONa
2. NH4OH + NH4Cl
3. HCOOH + HCOONa
4. C6H5OH + C6H5OO NH4
28. Аммонийный буферный раствор (укажите формулу) предназначен для поддержания:
1. рН=0 3. рН< 7
2. рН> 7 4. рН=7
29. Аммонийный буферный раствор (укажите формулу) предназначен для поддержания:
1. рН~0 3. рН~7
2. рН~4 4. рН~9
30. Для разбавления 20, 0 см3, 0, 1 моль/дм3 раствора комплексона III в 10 раз следует взять колбу вместимостью (см3):
1. 50
2. 100
3. 200
4. 100
31. Химическая посуда для разбавления 0, 2000 моль/дм3 раствора Н2С2O4
| 1. мерный цилиндр | 2. мерная пипетка |
| 3. коническая колба | 4. бюретка |
| 5. мерная колба | 6. химический стакан |
32. Вычислите молярную концентрацию (моль/дм3) раствора карбоната кальция, приготовленного растворением навески массой 5, 2000 г в мерной колбе вместимостью 500 см3.
| 1. 1, 0400. | 3. 0, 1040. |
| 2. 0, 0208. | 4. 0, 2080. |
Кислотно-основное титрование (Протолитометрия)
1. Формула соли, в водном растворе которой индикатор фенолфталеин приобретает малиновую окраску, имеет вид
1. К2НРО4
2 К2SO4
3 KNO3
4 FeSO4
2. Формулы солей, водные растворы которых можно различить, используя индикатор фенолфталеин, имеют вид:
1. FeSO4 и Na2SO4 3. Na2S и Na2SO4
2. FeSO4 и Al2(SO4)3 4. Na2S и Na2SO3
3. Какова окраска индикатора фенолфталеина в точке эквивалентности системы НСl + NaOH?
| 13. Синяя. | 15. Малиновая. |
| 14. Фиолетовая. | 16. Бесцветная. |
4. Формула вещества, 0, 01 М раствор которого характеризуется наибольшим значением рН, имеет вид
1. Cu(OH)2
2. КOH
3. KHCO3
4. K2CO3
5. Формула вещества, 0, 01 М раствор которого характеризуется наименьшим значением рН, имеет вид
1. Ca(OH)2
2. HClO4
3. CH3COOH
4. CuCl2
6. Формула вещества, 0, 1 М раствор которого характеризуется наименьшим значением рН, имеет вид
1. H2СO3 3. НCl
2. H2S 4. Nа2НРO4
7. Значение рН 0, 01 М раствора азотной кислоты (a = 1), равно……
1. 1
2. 2
3. 0
4. 3
8. В процессе кислотно-основного титрования в растворе изменяется (несколько ответов):
1. pH
2. Е;
3. рК;
4. pМе;
5. рТ;
6. СН+;
9. Для 0, 1 моль/дм3 раствора HCOOH рН составляет
1. 2, 88 3. 1, 38
2. 2, 38 4. 1, 0
10. На титрование раствора NaOH, содержащего 0, 1 г вещества, израсходовано
21, 5 см3 раствора HCl с молярной концентрацией 0, 1 моль/дм3. Массовая доля NaOH в образце равна ____%
1. 76 3. 86
2. 96 4. 100
11. В основе кислотно-основного титрования находится реакция:
1. H++OH  =H2O
=H2O
2. Ag++Cl-= AgCl↓
3.J2+2S2O32-=S4O62-+2J-
4.Ca2++Na2H2Y= Na2CaY+2Н+
12. Кривые титрования строятся для:
1. определения концентрации титранта;
2. определения объема титранта;
3. выбора индикатора;
3. установления области скачка;
13. Рассчитать значение рН в точке эквивалентности при титровании раствором гидроксида натрия раствор уксусной кислоты и выбрать наиболее эффективный индикатор (ответ обосновать).
| 1. Метиловый оранжевый (∆ pH = 3, 1–4, 4) |
| 2. Метиловый красный (∆ pH = 4, 4–6, 2) |
| 3. Бромтимоловый синий (∆ pH = 6, 0–7, 6) |
| 4. Фенолфталеин (∆ pH = 8, 2–9, 8) |
| 5. Тимолфталеин (∆ pH = 9, 3–10, 5) |
14. В чем состоит действие ауксохромных групп?
1. Сообщают окраску.
2. Стабилизируют окраску.
3. Усиливают окраску.
4. Ослабляют окраску.
15. Масса гидроксида калия, содержащего в 10 л его раствора, значение рН которого равно 11, составляет __________ г (a = 1).
1. 0, 56
2. 0, 28
3. 0, 112
4. 0, 56
16. Масса азотной кислоты, содержащаяся в 5 л ее раствора, значение рН которого равно 3, составляет __________ г (a = 1).
1. 0, 126
2. 0, 315
3. 0, 063
4. 0, 56
17. Величина pH в точке эквивалентности больше 7 при титровании…
1. Сильной кислоты сильным основанием
2. Слабой кислоты сильным основанием
3. Сильного основания сильной кислотой
4. Слабого основания сильной кислотой
18. Величина pH в точке эквивалентности меньше 7 при титровании…
1. Сильной кислоты сильным основанием
2. Слабой кислоты сильным основанием
3. Сильного основания сильной кислотой
4. Слабого основания сильной кислотой
19. При определении концентрации щелочи в растворе методом кислотно-основного титрования в качестве индикатора используется …
1. мурексид
2. фенолфталеин
3. эриохромовый черный
4. дифениламин
20. Фиксирование точки эквивалентности при титровании раствора гидроксида калия раствором серной кислоты в присутствии метилового оранжевого производят при достижении титруемым раствором …… цвета.
1. розового
2. оранжевого
3. красного
4. желтого
21. Фиксирование точки эквивалентности при титровании раствора гидроксида калия раствором серной кислоты в присутствии метилового оранжевого производят при достижении титруемым раствором …… цвета.
1. розового
2. оранжевого
3. красного
4. желтого
22. Объем 0, 1 М раствора HNO3, необходимый для нейтрализации раствора гидроксида калия, содержащего 0, 084 г КОН, равен ________ мл.
1. 84
2. 42
3. 15
4. 150
23. Объем раствора гидроксида натрия с молярной концентрацией эквивалентов 0, 1 моль/л, необходимый для нейтрализации 15 мл раствора серной кислоты с молярной концентрацией эквивалентов 0, 2 моль/л, равен ________ мл.
1. 45
2. 30
3. 20
4. 15
24. Для нейтрализации 25 мл раствора гидроксида калия с молярной концентрацией эквивалентов 0, 2 моль/л требуется ________ мл раствора серной кислоты с молярной концентрацией эквивалентов 0, 1 моль/л.
1. 50
2. 100
3. 12, 5
4. 25
25. Объем 0, 1 М раствора HCl, необходимый для нейтрализации раствора гидроксида натрия, содержащего 0, 08 г NaОН, равен ________ мл.
1. 30
2. 40
3. 20
4. 10
26. Для нейтрализации 25 мл раствора гидроксида калия с молярной концентрацией эквивалентов 0, 2 моль/л требуется _________ мл раствора серной кислоты с молярной концентрацией эквивалентов 0, 1 моль/л (с точностью до точного значения).
27. Объем раствора гидроксида бария с молярной концентрацией эквивалентов 0, 1 моль/л, необходимый для нейтрализации 25 мл раствора соляной кислоты с молярной концентрацией эквивалентов 0, 2 моль/л, равен ______ мл (с точностью до точного значения).
28. Объем 0, 1 М раствора NаOН, необходимый для нейтрализации раствора серной кислоты, содержащего 0, 147 г Н2SO4, равен ______ мл (с точностью до точного значения).
29. Объем раствора серной кислоты с молярной концентрацией эквивалентов 0, 05 моль/л, необходимый для нейтрализации 15 мл раствора гидроксида натрия с молярной концентрацией эквивалентов 0, 1 моль/л, равен ______ мл (с точностью до точного значения).
30. Объем 0, 1 М раствора КOН, необходимый для нейтрализации раствора азотной кислоты, содержащего 0, 126 г НNO3, равен ______ мл (с точностью до точного значения).
31. Объем 0, 1 М раствора NаOН, необходимый для нейтрализации раствора соляной кислоты, содержащего 0, 073 г НCl, равен ______ мл (с точностью до точного значения, Ar (Cl) = 35, 5).
32. При кислотно-основном титровании 100 мл минеральной воды, содержащей гидрокарбонаты кальция и магния, раствором соляной кислоты с молярной концентрацией эквивалента 0, 05 моль/дм3 затрачено 13, 90 см3 титранта. Рассчитать массу гидрокарбонат-ионов, содержащуюся в 1 л этого раствора.
33. Методом кислотно-основного титрования в растворе можно определить
1. NaCl 3. Na2C2O4
2. KNO3 4. K2SO4
34. Можно ли методом кислотно-основного титрования определить содержание орто-борной кислоты H3BO3, Kj= 5, 8.10-10
1. Можно, титрант NaOH
2. Нельзя, Kj< 5, 8.10-8
3. Нельзя, отсутствует скачок на кривой титрования
4. Можно, в неводных средах
35. Задача протолитометрии, решаемая в присутствии индикатора, константа ионизации которого Кi = 1·10–10
| 1. NH4OH + НСl. | 3. NaОН + Н2SO4. |
| 2. НСl + КOH. | 4. NaOH + НСООН. |
36. Интервал pH изменения окраски индикатора зависит от …
1. концентрации индикатора
2. константы диссоциации индикатора
3. pH титруемого раствора
4. интенсивности окраски индикатора
37. Выберите титрант и индикатор для определения в растворе CH3COOH:
1. HCl и метиловый оранжевый
2. KOH и метиловый оранжевый
3. Na2B4O7 и фенолфталеин
4. KOH и фенолфталеин
38. На тирование 20 см3 раствора NaOH израсходовано 25 см3 раствора HCl c молярной концентрацией 0.08 моль/дм3. Масса щелочи (г.) в 200 см3 этого раствора равна
1. 2, 4 3. 3, 2
2. 0, 8 4. 1, 6
39. Рассчитайте массу уксусной кислоты (СН3СООН) в 500 см3 раствора, если на титрование затрачено 10, 0 см3 ее затрачено 10, 5 см3 0, 1 моль/дм3 раствора NaOH.
40. При титровании смеси кислот HCl и CH3COOH в присутствии метилового оранжевого оттитровывается
1. HCl 3. HCl и CH3COOH
2. CH3COOH 4. CH3COOH и ½ HCl
Ответ обосновать.
41. Титрант метода кислотно-основного титрования
1. Сильный восстановитель
2. Сильное основание
3. Слабое основание
4. Слабый окислитель
5. Комплексон III
6. Иод
42. При титровании раствора молочной кислоты раствором NaOH используют индикатор:
1. Фенолфталеин
2. Метиловый оранжевый
3. Эриохромовый черный
4. Дифениламин
Ответ обоснуйте.
43. На титрование 25 см3 раствора гидроксида калия затрачено 20 см3 раствора азотной кислоты с молярной концентрацией 0, 1 моль/ дм3. Масса щелочи (г) в 500 см3 этого раствора равна
1. 1, 12 3. 2, 24
2. 5, 6 4. 4, 48
44. Ортофосфорная кислота H3PO4 с молярной концентрацией эквивалента 0, 1 моль/дм3 оттитрована как одноосновная раствором NaOH с молярной концентрацией 0, 1 моль/дм3 в присутствии индикатора
1. Метилового оранжевого 3. Нейтрального красного
2. Фенолфталеина 4. п-нитрофенола
45. Сколько скачков на кривой титрования смеси кислот HCl и HNO3?
1. Два 3. Отсутствует
2. Один 4. Нельзя выбрать индикатор
46. Укажите систему, для которой точка эквивалентности находится
в кислой среде.
| 1. НСl + NaOH. | 2. КОН + Н2SO4. |
| 3. NH4OH + НСl. | 4. NaOH + СН3СООН. |
47. Рассчитайте массу двуводной щавелевой кислоты в 500 см3 раствора, если на титрование затрачено 10, 0 см3 ее затрачено 10, 5 см3 0, 1 моль/дм3 раствора NaOH:
48. Задача, решаемая в протолитометрии в присутствии индикатора с Кi=10–4
1. H2C2O4+ NaOH
2. NH4OH +HCl
3. HCOOH + NaOH
4. NH4OH + CH3COOH
49. Ацидиметрически можно оттитровать:
| 1. NaOH,. NH4ОН | 3. НCl | 5. Н2С2О4, FeSO4 |
| 2. NH4Cl, NaCl | 4. СН3СООNa, NaCl | 6. CaCl2, MgCl2 |
Окислительно-восстановительное титрование (редоксиметрия)
1.  = 1, 51 В. Восстановить
= 1, 51 В. Восстановить  - в кислой среде (ответ поясните) может…
- в кислой среде (ответ поясните) может…
1. KBrO3;  = 1, 52 В
= 1, 52 В
2. Na2C2O4;  = 0, 49 B
= 0, 49 B
3. H2O2;  = 0, 77 B
= 0, 77 B
4. Na2S4O8;  = 2, 0 B
= 2, 0 B
5. F2;  -= 2, 87 B
-= 2, 87 B
2. Окислительно-восстановительные индикаторы – это органические аналитические реагенты, которые изменяют свою окраску при …
1. определенном значении потенциала
2. образовании комплексного соединения с титрантом
3. изменении pH
4. образовании комплексного соединения с титруемыми ионами
3. Автокаталитической называется реакция …
| 17. один из реагентов которой является катализатором этой реакции; |
| 18. один из продуктов которой является катализатором этой реакции; |
| 19. которая протекает без участия катализатора; |
| 20. в которой точку эквивалентности фиксируют по изменению окраски одного из участников реакции |
4. Действием азотной кислоты (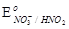 = + 0, 94 В) можно окислить:
= + 0, 94 В) можно окислить:
1. Mn2+ ; 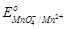 = + 1, 51 В. = + 1, 51 В.
| 3. F–;  = + 2, 87 В. = + 2, 87 В.
|
2. Br–; 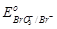 = + 1, 45 В. = + 1, 45 В.
| 4. I–;  = + 0, 54 В. = + 0, 54 В.
|
5. Способ фиксирования точки эквивалентности (ТЭ) в перманганатометрии:
1. рН-индикатор;
2. металлоиндикатор;
3. безиндикаторный;
4. редокс-индикатор;
6. Продукты реакции FeSO4+KMnO4+H2SO4→
1. Fe2(SO4)2
2. MnSO4
3. MnO2
4. K2SO4
5. H2O
6. K2MnO4
Напишите уравнение реакции, расставьте коэффициенты.
7. Титрант в перманганатометрии:
1. KMnO4;
2. MnSO4;
3. Fe SO4;
4. Na2S2O3;
5. Na2S2O3;
6. KBrO3;
8. При титровании раствора щавелевой кислоты раствором перманганата калия изменяется:
| 1. Е | 3. рК |
| 2. рН | 4. рМе |
9. Методом прямого перманганатометрического титрования в растворе можно определить
1. сульфат железа (II)
2. дихромат калия
3. щавелевую кислоту
4. уксусную кислоту
10. Укажите стехиометрический коэффициенты перед окислителем в реакции FeSO4 + KMnO4 + H2SO4 ®
11. Титрант метода иодометрия (несколько вариантов):
1. Сульфат железа
2. Тиосульфат натрия
3. Комплексон III
4. Гидроксид натрия
12. Вещество, которое нельзя восстановить действием Na2S2O3.
 = + 0, 09 В.
= + 0, 09 В.
1. CO2;  = - 0, 49 B. = - 0, 49 B.
|
2. I2; 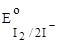 = + 0, 54 B. = + 0, 54 B.
|
3. FeCl3;  = + 0, 77 B. = + 0, 77 B.
|
4. KMnO4;  = + 1, 51 B. = + 1, 51 B.
|
13. Титранты метода иодометрии (несколько вариантов):
| 1. I2 | 2. Na2S2O3 |
| 3. KI | 4. KIO3 |
14. При определении окислителей методом иодометрии в качестве способа титрования, стандартного вещества и индикатора применяют …
| Способ титрования | Стандартное вещество | Индикатор | ||
| 1. Прямое | 1. Н2С2О4 | 1. крахмал | ||
| 2. Заместительное | 2. Н2С2О4 · Н2О | 2. фенолфталеин | ||
| 3. Обратное | 3. Na2S2O3 | 3. эриохромовый черный Т | ||
| 4. K2Cr2O7 | 4. безиндикаторное титрование | |||
| 5. крахмал | 5. дифениламен |
15. Скачок на кривой титрования в редоксиметрии при использовании в качестве индикатора эриоглауцина (Е0ind = 1, 00 В) составляет
1. 0, 60….....1, 00
2. 0, 80….....1, 40
3. 1, 10….....1, 31
4. 0, 60….....0, 90
16. Почему для подкисления растворов в перманганатометрии не применяется HCl, а в основном H2SO4?
1. Происходит реакция окисления хлорид-ионов перманганат-ионами
2. Улетучивается часть хлора, образовавшегося в результате окисления хлорид-ионов
3. Повышается расход перманганата калия на титрование анализируемого вещества
4. Объясняется всеми вышеперечисленными причинами.
17. Какой ион можно окислить KMnO4 в кислой среде?  = + 1, 51 В.
= + 1, 51 В.
1. Bi3+;  = + 1, 80 B. = + 1, 80 B.
|
2. NO2–;  = + 0, 94 B. = + 0, 94 B.
|
3. SO42–;  = + 2, 01 B. = + 2, 01 B.
|
4. F–;  = + 2, 87 B. = + 2, 87 B.
|
18. Найдите стехиометрический коэффициент перед окислителем в реакции
KMnO4 + H2C2O4 + H2SO4 → MnSO4 + CO2 + K2SO4 + H2O.
| 1. 10. | 3. 2. |
| 2. 1. | 4. 5. |
19. На титрование 10, 00 см3 раствора иода затрачено 9, 50 см3 раствора тиосульфата натрия с концентрацией с(1/1Na2S2O3) = = 0, 01 моль/дм3. Вычислите массу (г) I2 в 100 см3 раствора.
| 1. 0, 2413. | 3. 0, 1207. |
| 2. 0, 1501. | 4. 12, 07. |
20. В какой последовательности окисляются ионы перманганатом?
 = + 1, 51 В.
= + 1, 51 В.
 = + 0, 15 В, = + 0, 15 В,
|  = – 0, 41 В, = – 0, 41 В,
| ||
 = + 0, 77 В. = + 0, 77 В.
| |||
| 1. Fe2+, Sn2+, Cr2+. | 3. Sn2+, Cr2+, Fe2+. | ||
| 2. Cr2+, Fe2+, Sn2+. | 4. Cr2+, Sn2+, Fe2+. | ||
21. На титрование раствора 7, 00 см3 I2 c титром 0, 01270 г/см3 затрачено 10, 00 см3 раствора Na2S2O3. Молярная концентрация раствора тиосульфата натрия составляет ____ моль/дм3.
22. Способ фиксирования ТЭ в иодометрии:
1. рН-индикатор;
2. специфический индикатор крахмал;
3. безиндикаторный;
4. редокс-индикатор