
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Комплексонометрия
|
|
1. В аналитических лабораториях общую жесткость воды определяют методом ______________титрования.
1. кислотно-основного
2. окислительно-восстановительного
3. осадительного
4. комплексонометрического
2. Фиксирование точки эквивалентности при титровании воды раствором комплексона III в присутствии аммонийного буферного раствора и индикатора эриохромового черного Т производят при.
1. достижении титруемым раствором вино-красного цвета;
2. переходе цвета титруемой взвеси из белого в красный;
3. выпадении белого осадка;
4. достижении титруемым раствором синего цвета.
3. Фиксирование точки эквивалентности при титровании сточной воды, содержащей ионы кальция, раствором комплексона III в присутствии аммонийного буферного раствора и индикатора эриохромового черного Т производят при достижении титруемым раствором …… цвета.
1. розового
2. оранжевого
3. красного
4. синего
4. Катионы, определяемые методом комплексонометрии
1. K+
2. Mg2+
3. H+
4. Ca2+
5. Na+
6. NH4+
5. Точку эквивалентности в комплексонометрии фиксируют,
| 1. примененяя специфический индикатор |
| 2. безиндикаторным способом |
| 3. применяя фенолфталеин |
| 4. примененяя металлоиндикаторы |
6. При комплексонометрическом титровании в титруемом растворе изменяется:
| 1. рМе. | 3. рН. |
| 2. рТ. | 4. Е. |
7. Буферная смесь, применяемая в комплексонометрии, для поддержания pH> 9
1. NH4OH+NH4Cl
2. CH3COOH+CH3COONa
3. HCOOH+HCOONa
4. C6H5OOH+C6H5OONH4
8. Укажите правильную формулу комплексоната магния:
1.     ООС–Н2С СН2 –СООNa ООС–Н2С СН2 –СООNa
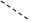    N–СН2 –СН2– N N–СН2 –СН2– N
 NaООС–Н2С СН2 –СОО NaООС–Н2С СН2 –СОО
  Мg Мg
|
2.      ООС–Н2С СН2 –СОО ООС–Н2С СН2 –СОО
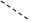    N–СН2 –СН2– N N–СН2 –СН2– N
 NaООС–Н2С СН2 –СОО NaООС–Н2С СН2 –СОО
  Мg Мg
 
|
3.  NaООС–Н2С СН2 –СООMg
N–СН2 –СН2– N NaООС–Н2С СН2 –СООMg
N–СН2 –СН2– N
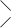 MgООС–Н2С СН2 –СООNa. MgООС–Н2С СН2 –СООNa.
|
4.   НООС–Н2С СН2 –СООMg
N–СН2 –СН2– N
NaООС– Н2С СН2 –СООН. НООС–Н2С СН2 –СООMg
N–СН2 –СН2– N
NaООС– Н2С СН2 –СООН.
|
9. Укажите правильную формулу комплексоната алюминия:
1     ООС–Н2С СН2 –СООNa ООС–Н2С СН2 –СООNa
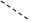    N–СН2 –СН2– N N–СН2 –СН2– N
 NaООС–Н2С СН2 –СОО NaООС–Н2С СН2 –СОО
  Al Al
|
2.      ООС–Н2С СН2 –СОО ООС–Н2С СН2 –СОО
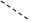    N–СН2 –СН2– N N–СН2 –СН2– N
 NaООС–Н2С СН2 –СОО NaООС–Н2С СН2 –СОО
  Al Al
 
|
3.  NaООС–Н2С СН2 –СООAl
N–СН2 –СН2– N NaООС–Н2С СН2 –СООAl
N–СН2 –СН2– N
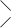 AlООС–Н2С СН2 –СООAl. AlООС–Н2С СН2 –СООAl.
|
4.   НООС–Н2С СН2 –СООAl
N–СН2 –СН2– N
NaООС– Н2С СН2 –СООН. НООС–Н2С СН2 –СООAl
N–СН2 –СН2– N
NaООС– Н2С СН2 –СООН.
|
10. На титрование 10, 0 см3 минеральной воды затрачено 10, 50 см3 0, 020 моль/дм3 раствора комплексона III. Рассчитайте жесткость анализируемой воды (ммоль/дм3).
| 1. 21, 0 | 3. 10, 5 |
| 2. 42, 0 | 4. 5, 25 |
11. На титрование 50, 00 см3 водопроводной воды затрачено 7, 50 см3 0, 02000 моль/дм3 раствора комплексона III. Вычислить жесткость анализируемой воды (ммоль/дм3).
| 1. 6, 0. | 3. 1, 5. |
| 2. 3, 0. | 4. 7, 5. |
12. Закончите уравнение стандартизации раствора комплексона III: Мg2+ + Н2Y2–…
 1. МgY2– + 2Н+. 1. МgY2– + 2Н+.
| 3.... МgY– + 2Н+. |
| 2.... МgY– + Н+. | 4.... МgY + 2Н+. |
13. При определении жесткости воды в колбу для титрования помещают …
| 1. раствор сульфата магния мерной пипеткой, аммонийный буферный раствор мерным цилиндром, эриохромовый черный Т на кончике шпателя; |
| 2. раствор сульфата магния и аммонийный буферный раствор мерными цилиндрами, эриохромовый черный Т на кончике шпателя; |
| 3. воду и аммонийный буферный раствор мерными пипетками, эриохромовый черный Т на кончике шпателя; |
| 4. воду мерной пипеткой, аммонийный буферный раствор мерным цилиндром, эриохромовый черный Т на кончике шпателя; |
14. Общая жесткость воды определяется присутствием
| 1. сульфатов, карбонатов К+ и Fe3+ |
| 2. сульфатов, карбонатов, гидрокарбонатов Mg2+ и Ca2+ |
| 3. хлоридов, гидрокарбонатов Mg2+ и Zn2+ |
| 4. карбонатов, гидрокарбонатов Са2+ и Al3+ |
15. Уравнение образования комплекса Ме2+ с комплексоном III: Ме2+ + Н2Y2– …
1.  ... МеY2– + 2Н+. ... МеY2– + 2Н+.
|
| 2.... МеY + 2Н+. |
| 3.... МеY– + Н+. |
| 4. … МеY2–+ Н+. |
16. Укажите метод и индикатор для определения жесткости воды:
1. Кислотно-основное титрование, эриохромовый черный Т;
2. Комплексонометрия, эриохромовый черный Т;
3. Йодометрия, крахмал;
4. Аргентометрия, хромат калия;
17. Металлиндикаторы – это аналитические реагенты, образующие окрашенные комплексы с …
1. титрантом
2. титрируемым ионом металла
3. ионом, входящим в состав буферной смеси
18. В процессе комплексонометрического титрования в растворе изменяется
1. pH 3. E 5. pT
2. pMe 4.pK 6.C(Me2+)
19. Соответствие между формулами комплексонов и их названиями:
1.

| 1. Двунатриевая соль этилендиаминтетрауксусной кислоты (ЭДТА), комплексон III |
2.

| 2. Нитрилотриуксусная кислота (НТУ), комплексон I |
3.
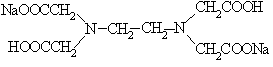
| 3. Этилендиаминтетрауксусная кислота (ЭДТУ), комплексон II |
20. Комплексонатами называют...
| 1. металлоиндикаторы |
| 2. титранты в комплексонометрии |
| 3. определяемые вещества в комплексонометрии |
| 4. циклические комплексные соединения комплексонов с металлами |
| 5. буферные растворы в комплексонометрии |
21. Комплексонометрическим методом можно определить в растворе:
1. Ca2+, Mg2+
2. Ca2+, Na2+
3. K+, Na+
4. Cu2+, K+
Написать уравнение реакции комплексообразования, находящейся в основе метода
22. Укажите метод и индикатор для определения жесткости воды
1. Кислотно-основное титрование, эозин
2. Комплексонометрия, эриохромовый черный Т
3. Йодометрия, крахмал
4. Аргентометрия, дихромат калия
23. В присутствие каких индикаторов можно селективно определить содержание ионов кальция и магния в растворе?
1. Фенолфталеин и ЭХЧ-Т 3. ЭХЧ-Т и мурексид
2. ЭХЧ-Т и эозин 4. Фенолфталиин и флуоресцин
24. Фактор эквивалентности Al3+ в реакции с ЭДТА…
1. 1/1 3. 1/3 5. 1/5
2. ½ 4.1/4 6.1/6
25. При прямом комплексонометрическом титровании окраска раствора изменяется, потому что в конечной точке титрования протекает реакция…
1. Меn+ + Ind- = МеIndn-1
2. МеIndn-1 +H2Y2 - = MеYn-4 + HInd + H+
3. Меn+ + H2Y2- = MеYn-4 + 2H+
26. Напишите уравнение реакции образования комплексоната кальция.
Укажите условия ее протекания.
27. Принцип действия металлоиндикатора при титровании заключается в изменении окраски раствора вблизи точки эквивалентности в результате
| 1. разрушения комплексоната металла |
| 2. образования комплекса металлоиндикатора с ионом титруемого металла |
| 3. разрушения комплекса металлоиндикатора с ионом титруемого металла |
| 4. образования комплексоната металла |
28. Среда, в которой возможно комплексонометрическое определение Са2+ и Mg2+.
| 1. щелочная. | 3. кислая. |
| 2. нейтральная. | 4. слабокислая. |
29. Реакция образования комплексоната железа (III) при рН = 2
1.  Fe 3+ + H2Y 2- FeY – + 2 H + Fe 3+ + H2Y 2- FeY – + 2 H +
|
| 2. Fe3+ + HY3- FeY– + H+ |
| 3. Fe3+ + Y4- FeY– |
| 4. Fe3+ + H3Y- FeY– + 3 H+ |
5. 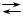 Fe 3+ + H4Y FeY – + 4 H + Fe 3+ + H4Y FeY – + 4 H +
|
23. Соли, вызывающие постоянную жесткость воды
| 1. CaCl2, BaCl2. |
| 2. Na2SO4, MgSO4. |
| 3. CaCl2, MgSO4. |
| 4. K2CO3, CaCO3. |
Осадительное титрование (Седиметрия)
1. Наименьшей растворимостью (моль/л) обладает карбонат двухвалентного металла, значение произведения которого равно
1. 3, 8∙ 10-9
2. 1, 8∙ 10-11
3. 4, 0∙ 10-10
4. 7, 5∙ 10-14
2. Масса оксалата кальция, содержащаяся в 5 л насыщенного раствора, равно ________мг (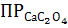 = 2, 3 ∙ 10-9)
= 2, 3 ∙ 10-9)
1. 6, 1
2. 30, 7
3. 15, 4
4. 61, 4
3. Концентрация сульфата бария в его насыщенном растворе составляет ________моль/л ( = 4, 0 ∙ 10-10)
= 4, 0 ∙ 10-10)
1. 2, 0∙ 10-5
2. 4, 0∙ 10-5
3. 2, 0∙ 10-10
4. 4, 0∙ 10-10
4. Объем 0, 1 М раствора NаOН, необходимый для осаждения железа в виде гидроксида из 20 мл 0, 05 М раствора нитрата железа (III), равен ________ мл (с точностью до точного значения).
1. 10
2. 30
3. 5
4. 20
5. При добавлении избытка раствора серной кислоты к 20 мл 0, 1 М раствора ВаCl2 образуется осадок массой ________ мг.
1. 0, 233
2. 0, 208
3. 0, 416
4. 0, 466
6. Объем раствора 0, 1 М хлорида бария, необходимый для осаждения сульфат-ионов из 200 мл 0, 025 М раствора серной кислоты, равен ______ мл (с точностью до точного значения).
Введите ответ:
7. Объем 0, 1 М раствора карбоната натрия, необходимый для осаждения ионов кальция из раствора, содержащего 0, 324 г его гидрокарбоната, равен ______ мл (с точностью до точного значения).
Введите ответ:
8. При сливании 200 мл 0, 1 М раствора Са(NО3)2 и 150 мл 0, 2 М раствора К2СО3 образуется осадок массой _________ г.
Введите ответ:
9. Фиксирование точки эквивалентности при титровании сточной воды, содержащей бромид калия, раствором нитрата серебра в присутствии хромата натрия в качестве индикатора производят при...
1. достижении титруемым раствором красного цвета;
2. переходе цвета титруемой взвеси из белого в красный;
3. выпадении белого осадка;
4. достижении титруемым раствором синего цвета.
10. Титрант и индикатор при определении хлорид-ионов в растворе методом Мора
1. AgNO3, Fe(III) 3. AgNO3, K2CrO4
2. I2, крахмал 4. KSCN, Fe(III)
Ответ пояснить уравнениями реакций.
11. Титрант и индикатор метода Фольгарда
1. AgNO3, K2CrO4 3 NH4SCN, K2CrO4
2. NH4SCN, NH4Fe(SO4)2 4. Na2S2O3, крахмал
12. Укажите титрант, стандартное вещество и индикатор при определении иодид-иона в растворе методом Мора
1. Na2S2O3, K2CrO4, крахмал
2. AgNO3, Na2S2O3, дифениламин
3. K2CrO4, H2C2O4, эозин
4. AgNO3, NaCl, K2CrO4
13. Какая реакция находится в основе метода осаждения?
1. 2I- - 2 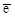 ® I2. ® I2.
| 3. Ag+ + Cl- ® AgCl. |
| 2. H+ + OH- ® H2O. | 4. Cu2+ + 4NH3 ® [Cu(NH3)4]2+. |
14. Индикатор метода Мора
1. К2Cr2O7 3. K2CrO4
2. AgNO3 4. FeNH4(SO4)2× 12H2O