
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Механизмы антибиотикорезистентности микроорганизмов
|
|
Антибиотикорезистентность - это устойчивость микробов к антимикробным химиопре-паратам. Бактерии следует считать резистентными, если они не обезвреживаются такими концентрациями препарата, которые реально создаются в макроорганизме. Резистентность может быть природной и приобретенной.
Природная устойчивость. Некоторые виды микробов природно устойчивы к определенным семействам антибиотиков или в результате отсутствия соответствующей мишени (например, микоплазмы не имеют клеточной стенки, поэтому не чувствительны ко всем препаратам, действующим на этом уровне), или в результате бактериальной непроницаемости для данного препарата (например, грамотрицательные микробы менее проницаемы для крупномолекулярных соединений, чем грамположительные бактерии, так как их наружная мембрана имеет «маленькие» поры).
Приобретенная устойчивость. Бактерии стали чрезвычайно быстро приспосабливаться, постепенно формируя устойчивость ко всем новым препаратам. Приобретение резистентности — это биологическая закономерность, связанная с адаптацией микроорганизмов к условиям внешней среды. В разной степени резистентность характерна для всех бактерий и всех антибиотиков. К химиопрепаратам адаптируются не только бактерии, но и остальные микробы — от эукариотических форм (простейшие, грибы) до вирусов. Проблема формирования и распространения лекарственной резистентности микробов особенно значима для внутрибольничных инфекций, вызываемых так называемыми «госпитальными штаммами», у которых, как правило, наблюдается множественная устойчивость к антибиотикам (так называемая полирезистентность ). Бактерии, способные к полирезистентности, являются природными хранилищами генов лекарственной устойчивости. Как известно, мутации, в том числе по признаку лекарственной устойчивости, спонтанны и возникают всегда.
Плазмидная устойчивость приобретается микробными клетками в результате процессов генетического обмена. Сравнительно высокая частота передачи R-плазмид обеспечивает широкое и достаточно быстрое распространение устойчивых бактерий в популяции, а селективное давление антибиотиков - отбор и закрепление их в биоценозах. Плазмидная устойчивость может быть множественной, т. е. к нескольким лекарственным препаратам, и при этом достигать достаточно высокого уровня.
Биохимическую основу резистентности обеспечивают разные механизмы:
• энзиматическая инактивация антибиотиков - осуществляется с помощью синтезируемых бактериями ферментов, разрушающих активную часть антибиотиков. Одним из таких широко известных ферментов является бета-лактамаза, обеспечивающая устойчивость микроорганизмов к бета-лактамным антибиотикам за счет прямого расщепления бета-лактамного кольца этих препаратов. Другие ферменты способны не расщеплять, а модифицировать активную часть молекулы антибиотиков, как это имеет место при энзиматической инактивации аминогликозидов и левомицетина;
• изменение проницаемости клеточной стенки для антибиотика или подавление его транспорта в бактериальные клетки. Этот механизм лежит в основе устойчивости к тетрациклину,
• изменение структуры компонентов микробной клетки, например изменение структуры бактериальных рибосом, сопровождается повышением устойчивости к аминогликозидам и макролидам, а изменение структуры РНК-синтетаз — к рифампицину.
У бактерий одного и того же вида могут реализовываться несколько механизмов резистентности. В то же время развитие того или другого типа резистентности определяется не только свойствами бактерий, но и химической структурой антибиотика.
Для борьбы с лекарственной устойчивостью, т. е. для преодоления резистентности микроорганизмов к химиопрепаратам, существует несколько путей:
• соблюдение принципов рациональной химиотерапии;
• создание новых химиотерапевтических средств, отличающихся механизмом антимикробного действия (например созданная в последнее время группа химиопрепаратов — фторхинолоны) и мишенями;
• постоянная ротация (замена) используемых в данном лечебном учреждении или на определенной территории химиопрепаратов (антибиотиков);
• комбинированное применение бета-лактамных антибиотиков совместно с ингибиторами бета-лактамаз (клавулановая кислота, сульбактам, тазобактам).
5. Методы определения чувствительности микроорганизмов к антибиотикам
Определение чувствительности микроорганизмов к антибактериальным препаратам методом серийных разведений (количественный метод). Данный метод определения антибиотикочувствительности является количественным и позволяет определить минимальную бактериостатическую и минимальную бактерицидную концентрации. Серийный метод титрования может быть выполнен в разных объемах среды (от 1 до 10 мл). Эксперименты выполняются в условиях асептики при использовании стерильных пипеток для каждого ингредиента реакции. Титрование можно проводить в плотных и жидких средах.
При титровании в жидких средах в ряд пробирок наливают питательную среду в строго определенном объеме. Количество пробирок определяется количеством разведений препарата, которое необходимо взять в опыт. В 1-ю пробирку вносят определенное количество раствора антибиотика, перемешивают, затем определенный объем смеси из 1-й пробирки переносят во 2-ю, перемешивают и переносят то же количество смеси из 2-й в 3-ю и т. д. Из последней пробирки, содержащей антибиотик, такой же объем смеси выливают, чтобы во всех пробирках объем жидкости был одинаков. Пробирка, не содержащая антибиотика, является контрольной. После этого во все пробирки, содержащие серийно разведенный антибиотик, и в контрольную пробирку вносят одинаковое количество взвеси тест-культуры. Штатив с пробирками встряхивают и ставят в термостат при 37°С на 18—20 ч.
Кратность разведения антибиотика обычно выбирают равной двум, для этого в каждую пробирку наливают, например, по 1 мл бульона, в 1-ю пробирку вносят 1 мл раствора антибиотика и переносят из пробирки в' пробирку по 1 мл смеси. При этом точность определения активности препарата составляет ±50%.
Взвесь клеток исследуемой культуры готовят на изотоническом растворе хлорида натрия при обязательном сравнении со стандартами мутности. При титровании антибактериальных антибиотиков микробная нагрузка обычно составляет 2, 5 × 105 микробных клеток на 1 мл раствора антибиотиков в питательном бульоне. Для этого готовят взвесь тест-культуры по стандарту 10 ед. мутности, что составляет 1 млрд. микробных тел в 1 мл. Взвесь разводят изотоническим раствором до концентрации 2, 5× 106 клеток в 1 мл и вносят в пробирки с серийно разведенным антибиотиком по 0, 1 мл на 1 мл питательного бульона. При использовании в качестве тест-культуры дрожжей микробная нагрузка составляет 4× 106 клеток в 1 мл.
Метод серийных разведений в плотных средах отличается тем преимуществом, что микробы-загрязнители при этом легко выявляются и по существу не изменяют общих результатов титрования, тогда как на жидких средах весь опыт может оказаться безрезультатным из-за попадания в пробирки хотя бы единичных клеток посторонних устойчивых микроорганизмов. Этот метод используют также при работе с микроорганизмами, которые не растут на обычных жидких средах, например, микобактерии туберкулеза, которые выращивают на среде, содержащей свернутую сыворотку. Вначале готовят ряд серийных разведений антибиотика, а затем вносят по 1 мл каждого разведения в пробирку, содержащую 4 мл расплавленной и охлажденной до 45—50°С агаризованной среды. Затем пробирки скашивают до застывания агара, а на поверхность плотной среды петлей засевают взвесь тест-культуры.
Для выявления бактерицидного действия препарата делают высев на МПА из всех пробирок, где визуально не отмечен рост микроорганизма. Для стойких антимикробных веществ, которые адсорбируются на микробных клетках и препятствуют их росту даже в свежей питательной среде, применяют соответствующие нейтрализаторы.
Определение чувствительности микроорганизмов методом дисков (качественный метод).
 | |||
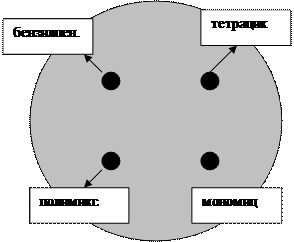 |
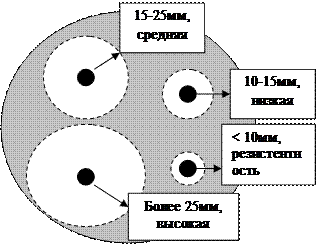
Диско-диффузионный метод используется для оценки эффективности антибиотиков в клинических условиях. Питательную среду (Мюллера-Хинтона, АГВ) разливают в чашки, помещенные на строго горизонтальной поверхности, заполнив их на одинаковую высоту 4 мм (25 мл среды для чашек с внутренним диаметром 9 см). Клинический материал или культуру микроорганизмов, выделенную от больного, засевают на поверхность питательного агара сплошным газоном. После посева крышку чашки приоткрывают не более чем на 15 мин и дают поверхности среды подсохнуть. Затем стерильным пинцетом следует положить на поверхность агара бумажные диски, пропитанные раствором определенного антибиотика, и слегка придавить. Расстояние между дисками и краем чашки должно быть не менее 15 мм. Чашки инкубируют около 18 ч при 37°С в перевернутом положении. При наличии чувствительной к антибиотику флоры вокруг соответствующих дисков отмечается зона угнетения роста микроорганизмов. Диаметр зоны измеряют с точностью до 1 мм, определяя чувствительность (высокая, средняя, низкая).
Рисунок 11. Определение чувствительности микроорганизмов к антибактериальным препаратам диско-диффузионным методом.
Ускоренный метод определения чувствительности микроорганизма к антибиотику
В чашку Петри наливают 15 мл питательного агара. После застывания агара на него наносят смесь 4 мл такого же агара, 1 мл взвеси тест-культуры (приготовленной по стандарту 1 млрд микробных клеток в 1 мл) и 1 мл 0, 2% водного раствора 2, 6-дихлорфенолиндофенола (рН 7, 2—7, 3). Вместо культуры можно использовать клинический материал. Затем на застывший агар ярко-синего цвета наносят диски, пропитанные антибиотиками, и чашки ставят в термостат при 37°С. Через 2-4 ч учитывают результаты по диаметру синих зон отсутствия роста. Резистентные к антибиотику микроорганизмы восстанавливают краситель, обесцвечивая его или трансформируя в желтый цвет. Данный краситель задерживает рост стафилококков, поэтому при работе с этим микроорганизмом раствор индикатора наливают на поверхность чашки в количестве 2—3 мл уже после выдерживания чашки с дисками в термостате. Избыток индикатора сливают через 5—7 мин и учитывают результаты.
Элипсометрическийи метод (Е-тест) занимает промежуточное положение между методом бумажных дисков и методом серийных разведений, являясь качественно-количественным методом. В нем используется узкая полоска полимера, пропитанная разными концентрациями антибиотика (от минимальных до максимальных), которая наносится на поверхность плотной питательной среды, предварительно засеянной испытуемой культурой. Задержка роста культуры вокруг полоски наблюдается в той зоне, где концентрация антибиотика выше МИК. На поверхности полоски нанесены типографским способом величины концентрации антибиотика в каждом участке. Если культура обладает чувствительностью к антибиотику, то зона задержки роста имеет каплевидную (элипсовидную) форму. За величину минимальной ингибирующей концентрации (МИК) антибиотика принимают отрезок полоски, к которому вплотную подходит рост микроба.

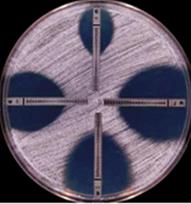
Рисунок 12. Определение чувствительности микроорганизмов с помощью Е-тестов.
III. План практической работы
1. Определить спектр действия антибиотиков
2. Определить чувствительности микроорганизмов к антибиотикам методом серийных разведений (количественный метод)
3. Определить чувствительность микроорганизмов к антибиотикам методом бумажных дисков (качественный метод)
4. Определить чувствительность микрофлоры зева к антибиотикам с помощью Е-теста
5. Разобрать основные группы химиопрепаратов и антибиотиков
6. Заполнить таблицы «Классификация антимикробных препаратов по механизму действия»
7. Решить ситуационные задачи
УИРС Определить чувствительность микрофлоры зева к антимикробным препаратам.