
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Сильные и слабые электролиты. Степень и константа диссоциации. Закон разведения Освальда.
|
|
Электролитическая диссоциация.
Сильные и слабые электролиты. Степень и константа диссоциации. Закон разведения Освальда.
*Растворы электролитов – растворы веществ, проводящие электрический ток. Обладают ионной проводимостью. Как правило – это растворы солей, кислот и оснований.
*Электрическая диссоциация – процесс распада вещества на ионы при растворении.
*Все электролиты делятся на слабые и сильные. Сильные электролиты характеризуются высокой степенью диссоциации.
Степень диссоциации:

ND – число диссоциированных молекул
N – общее число растворенных молекул.
Для сильных электролитов α → 1 Для слабых электролитов α < < 1
К сильным электролитам относятся сильные кислоты (серная, соляная, азотная [H2SO4, HCl, HNO3]) и большая часть солей. К слабым электролитам относятся слабые кислоты, слабые основания и некоторые соли [H2SO3, H2S, CH3COOH].
| Константа равновесия в общем случае: |
*В растворах слабых электролитов процесс диссоциации протекает обратимо и следовательно к нему может быть применен закон действующих масс. Рассмотрим процесс диссоциации кислоты HA↔ H++A-Степень диссоциации:
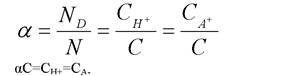

Для процесса диссоциации константа равновесия называется константой диссоциации и равна

Это выражение называют законом разведения Освальда. Из него видно, что KD зависит от концентрации. Иногда вместо концентрации используют обратное значение – разведение. v=1/c
