
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Водородный показатель pH.
|
|
В незначительной степени, но всегда в чистой воде протекают такая реакция:
H2O↔ H++OH-
эта реакция называется реакцией автопротолиза воды. Ион водорода H+ сразу же присоединяется к молекуле воды и образует ион гидроксония H++H2O-> H3O+. Для простоты говорят о присоединении в воде ионов H+.
В воде всегда присутствуют ионы H+.
константа диссоциации может быть вычислена по формуле

Зная, что масса моля воды – 18г, а масса одного литра воды – 1000г, найдем молярную концентрацию воды:

тогда

- ионное произведение воды.
При температуре Т=298К ионное произведение воды КВ=1, 008-14. В чистой воде
 , если же среда не нейтральная, то
, если же среда не нейтральная, то 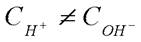 , но
, но  выполняется ВСЕГДА!!!
выполняется ВСЕГДА!!!
*Активность. а=γ С. Коэффициент активности γ - поправка, которая вводится для того, чтобы законы, верные для идеальных растворов были верными для реальных. Коэффициент зависит от концентрации. При С→ 1 γ → 1 и тогда
 -всегда
-всегда
Однозначность этой связи позволяет для определения кислотности или щелочности можно использовать величину, которую называют - водородным показателем pH=-lg(aH+)
*Водородный показатель, pH (произносится «пэ аш»), — это мера активности (в случае разбавленных растворов совпадает с концентрацией) ионов водорода в растворе, количественно выражающая его кислотность, вычисляется как отрицательный десятичный логарифм концентрации водородных ионов, выраженной в молях на литр:

pH> 7 – щелочная среда
pH< 7 – кислая среда
pH=7 – нейтральная среда
Роль pH в химии и биологии
Кислотность среды имеет важное значение для множества химических процессов, и возможность протекания или результат той или иной реакции часто зависит от pH среды. Для поддержания определённого значения pH в реакционной системе при проведении лабораторных исследований или на производстве применяют буферные растворы, которые позволяют сохранять практически постоянное значение pH при разбавлении или при добавлении в раствор небольших количеств кислоты или щёлочи.
Водородный показатель pH широко используется для характеристики кислотно-основных свойств различных биологических сред.