
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лабораторная работа № 8
|
|
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Цель работы:
Опыт 1. Зависимость электропроводности растворов от степени диссоциации электролитов
Основные понятия: электролитическая диссоциация, сильный электролит, слабый электролит, степень диссоциации, электропроводность растворов электролитов
Таблица. Результаты измерений электропроводности
| Электролит | Уравнение диссоциации | Концентрация раствора С, моль/л | Сила тока I, мА | Относительная сила электролита |
| HCl | 0, 1 | сильный | ||
| CH3COOH | 0, 1 | слабый | ||
| NaOH | 0, 1 | сильный | ||
| NH4OH | 0, 1 | слабый |
Выводы: (отмечают связь величины электропроводности растворов электролитов со степенью диссоциации электролита)
Опыт 2. Зависимость электропроводности раствора от концентрации сильного электролита
Электролит: H2SO4
Уравнение диссоциации:
Таблица. Результаты измерений электропроводности растворов H2SO4
| Концентрация раствора w, % | Сила тока I, мА | Концентрация раствора w, % | Сила тока I, мА |
График зависимости I = f (w)
I, мА
½
½
½
½
½
½
½
½
½
½
½
½ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ®w, %
Выводы: (объясняют вид зависимости I = f (w), учитывая, что H2SO4 – сильный электролит)
Опыт 3. Определение направления протекания реакций с участием электролитов
Основные понятия: сильный электролит, слабый электролит, константа диссоциации
1) Реагенты: NH4Cl, NaOH.
Уравнение реакции:
Наблюдения:
Сильные электролиты:
Слабые электролиты: (K b(NH4OH)=1, 77 × 10–5)
2) Реагенты: CH3COONa, HCl.
Уравнение реакции:
Наблюдения:
Сильные электролиты:
Слабые электролиты: (K а(СН3СООН)=1, 86× 10–5)
Выводы: (указывают направление протекания изученных реакций, используя данные по константам диссоциации соответствующих электролитов)
Опыт 4. Определение и сравнение рН растворов сильных и слабых электролитов
Основные понятия: водородный показатель рН, гидроксидный показатель рОН, связь между ними, степень диссоциации.
Основные законы: закон разбавления Оствальда для бинарного слабого электролита
Расчетные формулы: для кислот: a = 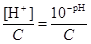 ; для оснований a =
; для оснований a = 
Таблица 1. Цвет универсального индикатора (раствора или бумаги)
| рН | Цвет | рН | Цвет |
| 1...3 | Красный | Бирюзовый | |
| 4, 5 | Оранжевый | 9, 10 | Голубой |
| Желтый | 11...13 | Фиолетовый | |
| Зеленый |
Таблица 2. Результаты измерения рН и расчета степени диссоциации электролита
| Электролит | Уравнение диссоциации | Концентрация раствора С, моль/л | рН | Степень диссоциации a |
| HCl | 0, 1 | |||
| CH3COOH | 0, 1 | |||
| NaOH | 0, 1 | |||
| NH4OH | 0, 1 |
Расчеты:
Выводы: (сравнивают рН и степень диссоциации соответствующих кислот и оснований)
Опыт 5. Смещение равновесия диссоциации слабого электролита
Основные понятия: принцип Ле Шателье смещения положения химического равновесия
Таблица. Результаты измерения рН растворов
| Изменения после добавления сильного электролита к слабому электролиту | |||||
| Электролит | Уравнение диссоциации | Увеличилась концентрация иона | Изменилось значение рН раствора | Равновесие диссоциации сместилось | |
| Слабый | CH3COOH | рН1 = | |||
| Сильный | CH3COONa | рН2 = | |||
| Слабый | NH4OH | рН1 = | |||
| Сильный | NH4Cl | рН2 = |
Выводы: (отмечают влияние сильного электролита с одноименным ионом на положение равновесия диссоциации слабого электролита и степень его диссоциации)
Опыт 6. Получение и растворение осадков малорастворимых электролитов
Основные понятия: произведение растворимости ПР, условия образования и растворения осадка.
а) Реагенты: CaCl2, Na2CO3
Уравнение реакции:
Наблюдения:
Выражение ПР соли, выпавшей в осадок:
Расчет произведения концентраций соответствующих ионов и сравнение с величиной ПР(СаСО3) = 3, 8× 10–9:
Вывод: (отмечают условие выпадения осадка)
б) Реагенты: продукты реакции (а), HCl
Уравнение реакции:
Сравнение силы соответствующих кислот: HCl Н2СО3 (K а (I)(Н2СО3) = 4, 3× 10–7)
в) Реагенты: продукты реакции (а), СН3СООН
Уравнение реакции:
Сравнение силы соответствующих кислот:
СН3СООН(K а(СН3СООН) = 1, 86× 10–5) Н2СО3 (K а(I)(Н2СО3) = 4, 3× 10–7 )
Вывод: (отмечают условие растворения осадка)
Опыт 7. Взаимодействие соединений, усиливающих гидролиз друг друга
Основные понятия: гидролиз солей
а) Соль: AlCl3
Уравнение гидролиза (по I ступени):
Сокращенное ионно-молекулярное уравнение гидролиза:
Результат определения рН раствора:
Вывод: (отмечают, к какому типу гидролиза относится гидролиз данной соли, чем это обусловлено и какова реакция среды)
б) Соль: Na2CO3
Уравнение гидролиза (по I ступени):
Сокращенное ионно-молекулярное уравнение гидролиза:
Результат определения рН раствора:
Вывод: (отмечают, к какому типу гидролиза относится гидролиз данной соли, чем это обусловлено и какова реакция среды)
в) Совместный гидролиз солей: AlCl3, Na2CO3
Уравнение реакции совместного гидролиза:
Наблюдения:
г) Доказательство образования в результате гидролиза амфотерного гидроксида алюминия – растворение осадка Al(OH)3 и в кислоте, и в щелочи:
Реагенты: продукты реакции (в), HCl
Уравнение реакции:
Наблюдения:
Реагенты: продукты реакции (в), NaOH
Уравнение реакции:
Наблюдения:
Выводы: (отмечают направление смещения положения равновесия гидролиза солей разного типа при их совместном гидролизе, указывают условия, при которых соли полностью гидролизуются)
Опыт 8. Влияния природы соли на процесс гидролиза
Основные понятия: степень гидролиза
а) Соль: NaCl
Определение рН раствора:
б) Соль: MgCl2
Определение рН раствора:
Уравнение гидролиза (по I ступени):
в) Соль: AlCl3
Определение рН раствора:
Уравнение гидролиза (по I ступени):
Сравнение силы соответствующих оснований:
NaOH Mg(OH)2 (K b (I)(Mg(OH)2)=2, 5× 10–3) Al(OH)3 (K b (I)(Al(OH)3)=1, 0× 10–9)
Выводы: (указывают, как степень гидролиза соли и. соответственно, рН раствора зависят от силы соответствующего основания или кислоты)
Опыт 9. Влияние температуры на степень гидролиза
Основные понятия: степень гидролиза, тепловой эффект химической реакции, принцип Ле Шателье смешения положения химического равновесия.
Соль: СН3СООNa. Индикатор: фенолфталеин. Условия проведения опыта: нагревание
Уравнение гидролиза:
Наблюдения:
Выводы: (отмечают смещение положения равновесия гидролиза при повышении температуры, показывают, как зависит степень гидролиза от температуры, каков знак теплового эффекта процесса)
Создатель документа Овчаренко Л.П.
|