
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Метали головних підгруп
|
|
Програмні вимоги до теми:
Розташування s - та p -елементів в періодичній системі. Будова та валентні можливості атомів. Зміна металічних (відновних) властивостей елементів в періодах, групах. Порівняльна характеристика елементів.
Знаходження елементів в природі.
Метали: фізичні та хімічні властивості, одержання, застосування. Розташування металів в ряду напруг. Сплави. Оксиди та гідроксиди елементів: кислотно-основний характер, властивості, одержання, застосування.
Солі. Гідроліз солей. Якісне визначення елементів в сполуках. Практичне застосування сполук. Твердість води.
Токсичність речовин, техніка безпеки при роботі з особливо отруйними речовинами.
Короткий виклад теоретичних питань:
| Загальна характеристика |
Метали головних підгруп І та ІІ групи періодичної системи є s -елементами. Атоми цих елементів мають на зовнішньому енергетичному рівні 1 (І група) або 2 (ІІ група) s -електрони. Вступаючи в хімічну взаємодію, атоми легко віддають електрони зовнішнього енергетичного рівня, виявляючи в сполуках постійний ступінь окиснення +1 (І група) або +2 (ІІ група). Загальна назва елементів головних підгруп І групи – лужні метали, ІІ групи (крім Mg та Ве) – лужно-земельні метали.
Радіуси атомів в групах послідовно збільшуються із збільшенням порядкового номеру елементу, в цьому ж напрямку зростає і здатність атомів віддавати електрони. Внаслідок високої відновної активності s -метали в природі зустрічаються тільки в окисленій формі, а в основі їх одержання лежить процес відновлення із окислених форм.
Метали головних підгруп ІІІ (Al, Ga, In, Tl), IV (Ge, Sn, Pb), V (As, Sb, Bi), VI (Po), групи періодичної системи є р -елементами. Ці елементи межують з діагоналлю B–At в періодичній системі елементів та розташовані нижче від неї. Оскільки ця діагональ умовно розділяє всі елементи на метали та неметали, то деякі метали, розташовані поблизу цієї діагоналі, можуть проявляти і окремі властивості неметалів. Наприклад, деякі з цих металів мають не металічну, а атомну кристалічну гратку, окремі з них розчиняються в розчинах лугів, а їхні оксиди та гідроксиди є амфотерними. Однак, в сполуках ці елементи проявляють тільки позитивні ступені окиснення; причому кількість валентних електронів визначається будовою зовнішнього енергетичного рівня, як це було показано в розділі “Неметали”. В напрямку, перпендикулярно вниз від вище означеної діагоналі у елементів спостерігається відповідне посилення металічних властивостей, так що елементом, який в найбільшій мірі проявляє металічні властивості, є Цезій.
Нижче в таблиці наведено розташування s - i р -металів у періодичній системі елементів, вказана будова зовнішнього електронного шару елементів та властиві їм ступені окиснення (виділено найбільш характерні), відмічено, які елементи мають атомну кристалічну гратку: (ат.). Також вказано, які з гідроксидів проявляють амфотерні ((амф.) чи кислотні (кисл.) властивості, що є ознакою вияву неметалічних властивостей.
| Період | Група | |||||
| I A | II A | III A | IV A | V A | VI A | |
| ns 1 | ns 2 | ns 2 np 1 | ns 2 np 2 | ns 2 np 3 | ns 2 np 4 | |
| Li +1 | Be +2(амф.)) | |||||
| Na +1 | Mg +2 | Al +3(амф.) | ||||
| K +1 | Ca +2 | Ga +3(амф.) | Ge(ат.) +2, +4 | As(ат.) +3, +5(кисл.) | ||
| Rb +1 | Sr +2 | In +3(амф.) | Sn +2(амф.), +4(амф.) | Sb(ат.) +3(амф.), +5(кисл.) | ||
| Cs +1 | Ba +2 | Tl +1, +3 | Pb +2(амф.), +4(амф.) | Bi(ат.) +3(амф.), +5(кисл.) | Po(ат.) (радіоакт) |
Із наведеної таблиці видно, що металічні властивості при переході від одного елемента до іншого у підгрупі зверху вниз і в періоді справа наліво плавно посилюються (кислотні–амфотерні–основні). Якщо один і той же елемент може проявляти декілька ступенів окиснення, то сполуки з меншою ступінню окиснення в більшій мірі проявляють металічні властивості, а також в більшій мірі характерні для даного елементу.
| Поширення у природі |
До найбільш поширених в земній корі металів відносяться Алюміній, Кальцій, Натрій, Калій, Магній, які входять до складу алюмосилікатів. У земній корі вони мають такі масові частки: Аl – 8, 8; Ca – 3, 60; Na – 2, 64; K – 2, 60; Mg – 2, 10. Алюмосилікати входять до складу багатьох гірських порід і глин. Важливими мінералами Алюмінію є боксит Al2O3° n H2O, корунд (рубін, сапфір) Al2O3, кріоліту Na3AlF6; Кальцію – мармур та вапняк CaCO3, гіпс CaSO4 · 2H2O, флюорит CaF2, фторапатрит Ca5(PO4)3F; Na – галіт (кам’яна сіль) NaCl, мірабіліт (глауберова сіль) Na2SO4 · 10H2O; К – сильвініт NaCl · KCl, карналіт KCl · MgCl2 · 6H2O, каїніт KCl · MgSO4 · 3H2O; Мg у природі зустрічається у вигляді мінералів магнезиту MgCO3, доломіту CaCO3 · MgCO3, у морській воді розчинені MgCl2 та MgSO4. Інші метали зустрічаються в природі в значно меншій кількості. Серед мінералів інших металів можна відмітити амблігоніт LiAl[PO4F] та сподумен LiAl[(SiO3)2], берил 3BeO · Al2O3 · 6SiO2 та хризоберил Be(AlO2)2, целестин SrSO4 та стронціан SrCO3, барит ВаSO4 та вітерит ВаCO3, аргідоніт 4Ag2S·GeS2, каситериту SnO2, галеніт PbS, тінкалNa2B4O7× H2O.
Інші елементи ІІІ групи, а також IV–V є рідкісними і розсіяними елементами: їх вміст в земній корі порядку 10–3–10–5%. Вони, як правило, зустрічають у вигляді домішок до природних сполук Цинку, Плюмбуму, Феруму, найчастіше у вигляді сульфідів. Відомі сульфідні мінерали: As2S3 – ауріпігмент, As2S4 – реальгар, Sb2S3 – антимоніт, Bi2S3 – бісмутін, FeAsS – арсенопірит, PbS – галеніт та оксидні: SnO2 – каситерит
| Прості речовини |
Фізичні властивості. Прості речовини є металами, окрім германію, арсену, стибію, бісмуту. Металам властиві металевий блиск, непрозорість, теплопровідність, хороша електрична провідність, пластичність. Лужні та лужноземельні метали – сріблясто-білі кристалічні речовини з малою густиною, м’які (деякі ріжуться ножем), легкоплавкі. На повітрі окиснюються, тому їх зберігають під шаром гасу. Берилій, магній, алюміній, індій, талій, оловостійкі до дії повітря завдяки існуванню на їх поверхні щільної оксидної плівки.
Алюміній, індійтагалій – сріблясті легкоплавкі метали (tпл.(Ga) = 29, 8oC) з малою густиною. Із всіх відомих речовин галій має найбільший температурний інтервал існування рідкого стану, що дозволяє використовувати його в термометрах для вимірювання високих температур. Індій найбільш рівномірно відбиває світлові хвилі, тому його використовують для виробництва дзеркал. На повітрі алюміній, індій, галій покриваються захисною оксидною плівкою, в той час як талій повільно окиснюється.
Стануміснує в вигляді білого блискучого металу (олово) та сірого крихкого напівпровідника, що утворюється з білого олова при пониженні температури.Свинець – м’який, пластичний легкоплавкий метал, покритий синювато-сірою окисною плівкою, тому не має металічного блиску.
Германій, арсен, стибій, бісмут мають атомну кристалічну гратку, що вказує на наближення їх властивостей до властивостей неметалів. Тому існують їх неметалічні і металічні модифікації, більш стійкими з них є металічні. Германій та металічний арсен – сріблясто-сірі речовини з металічним блиском. Стибій – кристалічний порошок сріблясто-білого кольору, а бісмут в конденсованому стані має сріблясте з червонуватим відтінком забарвлення. Всі вони електропровідні, але крихкі. Германій та арсен є напівпровідниками.
Хімічні властивості.
s -метали виявляють високу хімічну активність, що зростає в групах із збільшенням порядкового номеру. У всіх реакціях вони є сильними відновниками. Тільки берилій проявляє амфотерні властивості – взаємодіє і з кислотами, і з лугами. Для них характерні реакції з неметалами, водою, кислотами, оксидами. Приклади відповідних реакцій подано нижче в таблиці.
| Основні взаємодії | Приклади реакцій | Особливості реакцій |
| З неметалами: | ||
| а) галогенами: | 2K + І2 Þ 2KІ Ba + І2 Þ BaІ2 2Na+Br2 Þ 2NaBr | лужні метали самозаймаються у фторі, хлорі, парі брому |
| б) киснем: | 4Li + O2 Þ 2Li2O 2Ca + O2 Þ 2CaO 2Na + O2 Þ Na2O2 Вa + O2 Þ ВаO2 К + О2 Þ КО2 | окислюються киснем повітря, рубідій і цезій самозаймаються, найбільш активні утворюють пероксиди |
| в)халькогенами: | 2K + S Þ K2S Mg + S Þ MgS | Be i Mg взаємодіють при нагріванні |
| г) іншими | 6Na + N2 Þ 2Na3N 3Ba + N2 Þ Ba3N2 2Na + H2 Þ 2NaH Ba + H2 Þ BaH2 2К+2С Þ К2С2 2Mg + 3C Þ Mg2C3 Ca + 2C = CaC2 | взаємодіють з H2, N2, P, C, B при нагріванні |
| З водою: | 2Na+2HОНÞ 2NaОH+Н2 Ca + 2H2O = Ca(OH)2 + H2 | К при взаємодії займається, Rb і Cs реагують з вибухом, Be i Mg вступають у взаємодію після механічного зняття оксидної плівки |
| З кислотами: | ||
| a) неокисниками: | 2Na+2HClÞ 2NaCl+Н2 2Na+H2SO4Þ Na2SO4+Н2 Ве+2HClÞ ВеCl2+Н2 | |
| б) окисниками: | 8Na+5H2SO4(к) Þ 4Na2SO4+H2S+4H2O 8Na+10HNO3(р)Þ 8NaNO3+NH4NO3+3H2O 8Na+10HNO3(к)Þ 8NaNO3+N2O+5H2O 4Ca+10HNO3(р)Þ 4Ca(NO3)2+NH4NO3+3H2O | H2SO4(к) відновлюється до H2S; HNO3(р) – до NH3 (NH4NO3); HNO3(к) – до N2O; Ве пасивується |
| в) з лугами | 2NaOH + Be Þ Na2BeO2 + H2 або 2NaOH + Be+2Н2О Þ Na2[BeOH]4 + H2 | амфотерні властивості проявляє тільки Ве |
| З оксидами: | 6Na+Fe2O3 Þ 2Fe+3Na2O 4Li + CO2 Þ C + 2Li2O 2Ca+MnO2 Þ Mn + 2CaO 2Mg + CO2 Þ C + 2MgO | Відновлюють менш активні метали та неметали з їх оксидів |
Аналогічні властивості проявляють і р -метали, однак в зв’язку з послабленням їх металічних властивостей в порівнянні з s -металами, а також з тим, що ці метали можуть проявляти декілька ступенів окиснення, відповідні реакції мають певні особливості.
Взаємодія з неметалами: р -метали окиснюються під дією сильних окисників – в першу чергу галогенів, кисню, халькогенів. Склад одержаних при цьому сполук залежить від декількох факторів: можливого ступеня окиснення металу, окислювальної здатності окисника, відносних кількостей взаємодіючих речовин. Сильні окисники здатні окислювати метали до максимально можливих ступенів окиснення. Продукти взаємодії р -металів з відповідними неметалами показано нижче в таблиці:
| Реакція | Продукти взаємодії металів | ||
| ІІІ групи | ІV групи | V групи | |
| Ме+Гал2 ® | AlF3; AlCl3; AlBr3; AlI3 | ||
| GaF3; GaCl3; GaBr3; GaI3 | GeF4; GeCl4; GeBr4; GeI4 | AsF3 (AsF5); AsCl3 (AsCl5); AsBr3 (AsBr5); але AsI3 | |
| InF3; InCl3; InBr3; InI3 | SnF4; SnCl4; SnBr4; SnI4 | SbF3 (SbF5); SbCl3 (SbCl5); SbBr3 (SbBr5); але SbI3 | |
| TlF3; TlCl3; TlBr3; TlI3 | PbF2; PbCl2; PbBr2; PbI2 | BiF3 (BiF5); BiCl3; BiBr3; BiI3 | |
Ме+О2 
| Al2O3 | ||
| Ga2O3 | GeO2 | As2O3 | |
| In2O3 | SnO2 | Sb2O3 | |
| Tl2O3 | PbO | Bi2O3 | |
| Ме+Халькоген | Al2S3; Al2Se3; Al2Te3 | ||

| Ga2S3; Ga2Se3; Ga2Te3 | GeS2; GeSe2; GeTe2 | As2S3; As2Se3; As2Te3; |
| In2S3; In2Se3; In2Te3 | SnS2; SnSe2; SnTe2 | Sb2S3; Sb2Se3; Sb2Te3 | |
| Tl2S (Tl2S3); Tl2Se; Tl2Te | PbS; PbSe; PbTe | Bi2S3; Bi2Se3; Bi2Te3 |
У взаємодію з іншими неметалами (слабшими окисниками) вступають тільки найбільш активні метали. Наприклад, алюміній взаємодіє з азотом, вуглецем:
2Al+N2 Þ 2AlN; 4Al+3C Þ Al4C3
Взаємодія з водою та розчинами кислот-неокисників: При вивченні можливих взаємодій необхідно враховувати покриття металу оксидною плівкою, розташування металів в ряду напруг, а також розчинність у воді продуктів реакції – оксидів, гідроксидів, солей.
В ряду напруг Ge, As, Sb, Bi розміщені після Н, тому вони його не витісняють, a Sn, Pb – безпосередньо перед Н; Al, Ga, In, Tl – активні металами.
| Реакція | Продукти взаємодії металів | ||
| ІІІ групи | ІV групи | V групи | |
| Ме+НОН ® | Al(OH)3+H2 (після видалення оксидної плівки) | ||
| Ga, In, Tl не взаємодіє | Ge, Sn, Pb не взаємодіє | As, Sb, Bi не взаємодіє | |
| Ме+HCl (H2SO4) ® | AlCl3+H2 | ||
| GaCl3+H2 | Ge не взаємодіє | As, Sb, Bi не взаємодіє | |
| InCl3+H2 | SnCl2+H2 | ||
| Tl не розчиняється внаслідок утворення на його поверхні нерозчинних солей відповідної кислоти | Pb не розчиняється внаслідок утворення на його поверхні нерозчинних солей відповідної кислоти | ||
| Ме+кислота, що утворює розчинні солі | 2CH3COOH+Pb = (CH3COO)2Pb+H2 |
Взаємодія з кислотами-окисниками: При вивченні можливості взаємодії металів необхідно враховувати можливість пасивування поверхні металу, а також розуміти механізм окиснення металу з допомогою концентрованих кислот: спочатку метал окиснюється до характерного йому оксиду, а потім, в залежності від характеру цього оксиду, той або розчиняється в надлишку кислоти з утворенням відповідної солі (основні оксиди), або залишається в осаді (нерозчинні у воді оксиди), або з водою утворює відповідну кислоту (кислотні оксиди).Так,
· метали ІІІ групи:
Al: не розчиняється в розбавл. і конц. HNO3 та конц.H2SO4: пасивується поверхня.
Ga i In: In+6HNO3 = In(NO3)3+3NO2+3H2O (розчин. з утворенням сполук Ga(III) i In(III))
Tl: Tl+4HNO3 = 3TlNO3+NO+2H2O (розчин. з утворенням сполук Tl(I))
· метали ІV групи:
Ge: Ge+4H2SO4конц. = Ge(SO4)2+2SO2+4H2O (розчиняється як метал з утворенням сполук Ge(IV))
Ge+4HNO3конц.= H2GeO3+4NO2+2H2O (розчиняється як неметал з утворенням сполук Ge(IV))
Ge в розбавленій HNO3. не розчиняється
Sn: Sn+4H2SO4конц. = Sn(SO4)2+2SO2+4H2O (розчиняється як метал з утворенням Sn(IV))
3Sn+8HNO3розб = 3Sn(NO3)2+2NO+4H2O (розчиняється як метал з утворенням Sn(II))
Sn+4HNO3конц.= H2SnO3+4NO2+2H2O (розчиняється як неметал з утворенням Sn(IV))
Pb: 3Pb+8HNO3розб = 3Pb(NO3)2+2NO+4H2O (розчиняється як метал з утворенням Pb(II))
Pb+4HNO3конц. = Pb(NO3)2+2NO2+2H2O (розчиняється як метал з утворенням Pb(II))
· метали V групи:
As: 2As+5H2SO4конц. = 2H3AsO4+5SO2+2H2O(розчиняється як неметал з утворенням As(V))
3As+5HNO3конц.+2H2O = 3H3AsO4+5NO (розчиняється як неметал з утворенням As(V))
Sb: 2Sb+10HNO3конц. = Sb2O5+10NO2+5H2O(розчиняється як неметал з утворенням Sb(V))
2Sb+2HNO3розб. = Sb2O3+2NO+H2O (розчиняється як неметал з утворенням Sb(V))
Bi: Bi не розчиняється в HNO3конц.– пасивується поверхня.
Bi+4HNO3розб = Bi(NO3)3+NO+2H2O (розчиняється як метал з утворенням Bi(III))
У водних розчинах лугів розчиняються деякі метали, що розташовані в ряду напруг до Н і утворюють амфотерні гідроксиди (берилій, алюміній, олово, свинець тощо):
Ве+2NaOH+2H2O = Na2[Ве(OH)4]+H2; аналогічно – Sn, Pb
2Al+2KOH+6H2O = 2K[Al(OH)4]+3H2; аналогічно – Ga
З оксидами металів у взаємодію вступають активні р -метали:
2Al+Cr2O3Þ Al2O3+2Cr
8Al+3Fe3O4Þ 4Al2O3+9Fe
З активними металами р-метали при сплавленні утворюють бінарні сполуки постійного складу, в яких роль р-метал проявляє відповідний групі негативний ступінь окиснення:
3Mg + 2As = Mg3As2 (арсенід магнію) 2Mg + Ge =Mg2Ge (германід магнію)
3Mg + 2Sb = Mg3Sb2 (антимонід магнію) 2Mg + Sn = Mg2Sn (станід магнію)
3Mg + 2Bi = Mg3Bi2 (арсенід магнію) 2Mg + Pb = Mg2Pb (плюмбід магнію)
Одержання. s –метали – найсильніші відновники з відомих речовин, тому в основному їх одержують відновленням з допомогою електричного струму – електролізом.
Натрій: а) електроліз розплаву NaCl 
2Na++2Cl–  2Na+Cl2
2Na+Cl2
б) відновленням соди вугіллям: Na2CO3+2C = 2Na+3CO
Калій: а) заміщенням його натрієм з розплаву хлориду калію: KCl+Na= K+NaCl
б) електролізом розплавів хлориду
Літій: а) електролізом розплаву хлориду
Рубідій, цезій: відновленням їх галогенідів в вакуумі: 2RbCl+Ca = 2Rb+CaCl2
2CsCl+Ca = 2Cs+CaCl2
Метали ІІ групи: електролізом розплавів їх солей або термічним відновленням їх сполук активнішими металами чи вуглецем: BaO+Ca  CaO+Ba; BeCl2+Mg
CaO+Ba; BeCl2+Mg  MgCl2+Be;
MgCl2+Be;
3CaO+2Al  3Ca+Al2O3; MgO+C
3Ca+Al2O3; MgO+C  MgO+CO
MgO+CO
Алюміній не може бути виділений з водних розчинів, оскільки він є дуже активним металом. Його одержують електролізом розплаву, що містить Al2O3 i Na3[AlF6]

4Al3++4AlO33–  4Al+2Al2O3+3O2
4Al+2Al2O3+3O2
Талій, галій та індій добувають електролізом
Арсен, стибій та бісмут добувають, відновлюючи їх оксиди вуглецем:
As2O3 + 3C = 2As + 3CO.
Германій одержують, обробляючи його диоксид соляною кислотою з подальшим відновленням утвореного хлориду:
GeO2 + 4HCl = GeCl4 + 2H2O,
GeCl4 + 2Mg = 2MgCl2 + Ge.
Олово, свинець, арсен, стибій, бісмут добувають, відновлюючи їх оксиди вуглецем. Оксиди, як правило, одержують, випалюючи їх сульфіди.
2As2S3+9O2 = 2As2O3+6SO2
As2O3+3C = 2As+3CO
| Сполуки елементів |
s-метали в сполуках проявляють ступені окиснення +1 (лужні метали) та +2 (лужно-земельні метали). Для алюмінію, галію, індію характерні сполуки з ступенем окиснення +3, а талію – +1; германію, стануму – +4, а плюмбуму – +2; арсену, стибію – +5, а бісмуту – +3.
| Оксиди |
Фізичні властивості: Тверді кристалічні речовини білого (Li2O, Na2O, CaO, MgO, SrO, Al2O3, Ga2O3, GеO2, SnO2), жовтого (K2O, Rb2O, Іn2O3), оранжевого (Cs2O), коричневого (Tl2O3), чорного (PbO2, Tl2O) кольору. Оксиди р -елементів практично нерозчинні в воді, тільки оксиди арсену (яскраво виражені кислотні властивості) та Tl2O (яскраво виражені основні властивості), вступають з водою у взаємодію.
Хімічні властивості: Оксиди s-металів є типовими основними оксидами, реакційна здатність і основні властивості яких підсилюються в групах із збільшенням порядкового номеру (тільки оксид берилію проявляє амфотерні властивості). Так, оксиди взаємодіють:
§ з водою з утворенням лугів Na2O+H2O = 2NaOH,
СаО+H2O = Сa(OH)2 (окрім ВеО та MgO)
§ з кислотними оксидами (з леткими та твердими при сплавленні)
Na2O+CO2= Na2CO3,
CaO + CO2 = CaCO3
§ з кислотами з утворенням солей та води: Na2O+H2SO4= Na2SO4+H2O
MgO + H2SO4 = MgSO4 + H2O
CaO + 2HCl = CaCl2 + H2O.
Для вищих оксидів р -металів спостерігається значне послаблення основних властивостей і посилення кислотних, що видно з таблиці зміни властивостей вищих оксидів (гідроксидів) елементів по групам і періодам:
| Номер періоду | Номер групи | |||||||
| І | ІІ | ІІІ | ІV | V | ||||
| Основні | амфотерні | кислотні | ||||||
| Li2O | BeO | B2O3 | CO2 | N2O5 | ||||
| Na2O | MgO | Al2O3 | SiO2 | Р2O5 | ||||
| K2O | CaO | Ga2O3 | GeO2 | As2O5 | ||||
| Rb2O | SrO | In2O3 | SnO2 | [Sb2O5]нестійкий | ||||
| Cs2O | BaO | Tl2O3 | [PbO2]нестійкий | [Ві2О5]не виділ | ||||
З таблиці видно, що деякі оксиди s- та р -металів з ступінню окиснення металу +2 (ВеО) та з ступінню окиснення металу +3 (Al2O3, Ga2O3, In2O3) проявляють амфотерні властивості, а це означає, що вони проявляють властивості і кислот (взаємодіють з основними оксидами та основами), і основ (взаємодіють з кислотними оксидами та кислотами). Ці взаємодії в загальному вигляді можна представити наступним чином:
| Взаємодія | Ме О | Ме 2О3 |
| З кислотами | Ме O+2HCl = Ме Cl2+H2O Мe O+H2SO4 = Мe SO4+H2O | Ме 2O3+6HCl = 2 Ме Cl3+3H2O Ме 2O3+3H2SO4 = Ме 2(SO4)3+3H2O |
| З розчинами лугів | МeO+2KOH+H2O = К2[Мe(OH)4] Мe O+Ва(OH)2+H2O = Ва[ Мe (OH)4] | Ме 2O3+2KOH+3H2O = 2K[ Ме (OH)4] Ме 2O3+Ва(OH)2+3H2O = Ва[ Ме (OH)4]2 |
| З лугами при сплавленні | Мe O+2NaOH  Na2 Мe O2+H2O Na2 Мe O2+H2O
| Мe 2O3+2NaOH  2Na Мe O2+H2O 2Na Мe O2+H2O
|
| З основними оксидами | Мe O+Na2O  Na2 Мe O2 Na2 Мe O2
| Мe 2O3+Na2O  2Na Мe O2 2Na Мe O2
|
Оскільки р -метали можуть виявляти різні ступені окиснення в сполуках, то існують оксиди одного й того ж металу з різними ступенями окиснення, причому оксиди елементів в нижчих ступенях окиснення є більш стійкими. Так, із вищих оксидів V групи складу Ме 2О5 (с.о. металу +5) одержані тільки As2O5 та Sb2O5 (нестійкий), але існують всі нижчі оксиди складу Ме 2О3 (с.о. металу +3): As2O3 (кислотний оксид), Sb2O3 (амфотерний оксид), Ві2О5 (основний оксид); поряд з вищими оксидами ІV групи складу Ме О2 (с.о. металу +4), відомі і нижчі оксиди складу Ме О (с.о. металу +2): GeO (амфотерний оксид з переважно кислотним характером), SnO (амфотерний оксид), PbО (амфотерний оксид з переважно основним характером); для елементів ІІІ групи відомий тільки один нижчий оксид (с.о.+1) – Tl2O (основний оксид). Очевидно, що в ряду однотипних сполук (наприклад, As2O3–Sb2O3–Ві2О5) кислотні ознаки слабшають і наростають основні.
Необхідно відмітити, що в цілому стійкість сполук з максимальним ступенем окиснення елементу зменшується при переході в групі зверху вниз.
Всі оксиди р -металів – тверді речовини. Деякі хімічні властивості оксидів наведені в таблиці:
| № групи | Нижчі оксиди | Вищі оксиди |
| ІІІ | – | Al2O3+6HCl = 2AlCl3+3H2O
Al2O3+2KOH+3H2O = 2K[Al(OH)4]
Al2O3+2NaOH  2NaAlO2+H2O
Al2O3+Na2O 2NaAlO2+H2O
Al2O3+Na2O  2NaAlO2 2NaAlO2
|
| – | Аналогічні властивості має Ga2O3, In2O3 | |
| Tl2O+H2O = 2TlОН Tl2O+2HCl = 2TlCl | Tl2O3+6HCl = 2TlCl3+3H2O
Tl2O3  Tl2O+O2 Tl2O+O2
| |
| IV | GeO+2NaOH+H2O = Na2[Ge(OH)4] GeO+2HCl = GeCl2+H2O | GeO2+2NaOHконц.  Na2GeO3+H2O Na2GeO3+H2O
|
| SnO+2NaOH+H2O = Na2[Sn(OH)4] SnO+2HCl = SnCl2+H2O | SnO2+2H2SO4конц.  Sn(SO4)2+2H2O
SnO2+2NaOH Sn(SO4)2+2H2O
SnO2+2NaOH  Na2SnO3+H2O Na2SnO3+H2O
| |
| PbO+2NaOH+H2O = Na2[Pb(OH)4] PbO+2HCl = PbCl2+H2O | 2CaO+PbO2  Ca2PbO4
2PbO+PbO2 Ca2PbO4
2PbO+PbO2  Pb2PbO4 Pb2PbO4
| |
| V | As2O3+3H2O = 2H3AsO3 As2O3+2NaOH+3H2O = 2Na[As(OH)4] As2O3+8HCl = 2HAsCl4+3H2O As2O3+4HNO3+7H2O = 6H3AsO4 | As2O5+3H2O = 2H3AsO4
As2O5+6NaOH = 2Na3AsO4+3H2O
2As2O5  2As2O3 + O2 2As2O3 + O2
|
| Sb2О5 в воді не розчиняється Sb2O3+2NaOH+3H2O = 2Na[Sb(OH)4] Sb2O3+8HCl = 2HSbCl4+3H2O | Sb2O5+3H2O = 2H3SbO4 розчин. мало
Sb2O5+2NaOH+5H2O = 2Na[Sb(OH)6]
Sb2O5+2NaOH  2NaSbO3+Н2О
2Sb2O5 2NaSbO3+Н2О
2Sb2O5  2Sb2O3 + O2 2Sb2O3 + O2
| |
| Ві2О5 в воді не розчиняється Ві2О5 з розчинами лугів не взаємодіє Ві2О5+6HCl = 2BiCl3+3H2O | – |
Для елементів, що мають оксиди з різними ступенями окиснення, характерні так звані змішані оксиди. Наприклад, оксиди складу Pb3O4 º 2PbO× PbO2; Pb2O3 º PbO·PbO2. Тому розклад PbO2 при нагріванні може відбуватися по-різному:
4PbO2  2Pb2O3 + O2
2Pb2O3 + O2
3PbO2  Pb3O4 + O2
Pb3O4 + O2
Аналогічним чином відбувається і розклад Sb2O5;
2Sb2O5  Sb2O4 + O2 (Sb2O4 º Sb2O3·Sb2O5).
Sb2O4 + O2 (Sb2O4 º Sb2O3·Sb2O5).
Лужні метали утворюють і сполуки, в яких є хімічні звязки –О–О– пероксиди складу Ме 2О2 та надпероксиди Ме О2. Схильність до утворення таких сполук і їх стійкість зростають від Li до Cs. Властивості пероксидів:
руйнуються водою: 2Na2O2+2H2O = 4NaOH+O2,
взаємодіють з оксидами неметалів: Na2O2 + CO = Na2CO3,
2Na2O2 + 2CO2 = 2Na2CO3 + O2,
та з кислотами: Na2O2+2H2SO4= 2NaНSO4+H2O2.
Відомий і пероксид барію ВаО2, що проявляє властивості солі пероксиду водню: реагує водою BaO2 + 2H2O = Вa(OH)2 + H2O2, та з кислотами BaO2 + H2SO4 = H2O2 + BaSO4.
Одержання: З лужних металів прямою взаємодією металу з киснем одержують тільки оксид літію, інші – непрямим шляхом, наприклад Na2O2+2Na = 2Na2O або 2NaOH+2Na = 2Na2O+H2.
Оксид алюмінію – спалюванням металу чи термічним розкладом гідроксиду.
Оксиди As2O3, Sb2O3, Ві2О5 одержують прямою взаємодією простих речовин, Sb2O3 також взаємодією Sb з розбавленою HNO3, а Ві2О5 – термічним розкладом Bi(NO3)3.
| Гідроксиди |
Фізичні властивості: Гідроксиди s-елементів – тверді кристалічні речовини білого кольору, добре розчинні у воді (крім Mg(OH)2 та Be(OH)2). Загальна назва – луги; окремі гідроксиди мають технічні назви: NaOН – їдкий натр, КОН – їдке калі. Гідроксиди р -елементів – в основному нерозчинні у воді студенисті осади (переважно білого кольору) не завжди визначеного складу.
Хімічні властивості: Гідроксиди s-елементів (та TlOH) – це типові розчинні у воді сильні основи (луги), сила яких зростає в групах із збільшенням порядкового номеру (гідроксид берилію–амфотерний). Так, луги взаємодіють:
§ з кислотними та амфотерними оксидами: 2NaOН+CO2= Na2CO3+H2O
2NaOН+Al2O3  2NaAlO2+H2O,
2NaAlO2+H2O,
§ з амфотерними гідроксидами NaOН+Al(OH)3 = Na[Al(OH)4]
NaOН+Al(OH)3  NaAlO2+2H2O
NaAlO2+2H2O
§ з кислотами з утворенням солі та води: 2NaOН+H2SO4= Na2SO4+2H2O
§ з pозчинами солей з утворенням осаду: 2NaOН+CuSO4= Na2SO4+Cu(OH)2¯
§ піддаються термічному розкладу (крім гідроксидів лужних металів, окрім 2LiOH  Li2O+H2O) 2TlOH
Li2O+H2O) 2TlOH  Tl2O+H2O)
Tl2O+H2O)
Be(OH)2  BeO + H2O
BeO + H2O
Амфотерність гідроксиду берилію: Ве(ОН)2+2NaОН = Na2[Ве(OH)4]
Ве(ОН)2+2НCl = BeCl2+2H2O
| Важливіші сполуки |
У гідроксидів р -елементів основний характер виражений значно слабіше, вони є нерозчинними у воді, тому для них характерні тільки взаємодія з кислотами та термічний розклад.
Кислотно-основний характер гідроксидів р -елементів такий же, як і у їх оксидів. Реакції амфотерних гідроксидів описуються відповідними рівняннями:
| Взаємодія | Ме (ОН)2 | Ме (ОН)3 |
| З кислотами | Ме (ОН)2+2HCl = Ме Cl2+2H2O Ме (ОН)2+H2SO4 = Мe SO4+2H2O | Ме (ОН)3+6HCl = 2 Ме Cl3+3H2O Ме (ОН)3+3H2SO4 = Ме 2(SO4)3+3H2O |
| З розчинами лугів | Ме (ОН)2+2KOH = К2[Мe(OH)4] Ме (ОН)2+Ва(OH)2 = Ва[ Мe (OH)4] | Ме (ОН)3+KOH = 2K[ Ме (OH)4] 2 Ме (ОН)3+Ва(OH)2 = Ва[ Ме (OH)4]2 |
| З лугами при сплавл. | Ме (ОН)2+2NaOH  Na2 Мe O2+2H2O Na2 Мe O2+2H2O
| Ме (ОН)3+NaOH  Na Мe O2+2H2O Na Мe O2+2H2O
|
| З основн. оксидами | Ме (ОН)2+Na2O  Na2 Мe O2+H2O Na2 Мe O2+H2O
| 2 Ме (ОН)3+Na2O  2Na Мe O2+3H2O 2Na Мe O2+3H2O
|
В Al(OH)3 i Ga(OH)3 кислотні і основні властивості виражені приблизно в однаковій мірі, в In(OH)3 основні властивості виражені сильніше від кислотних, а в Tl(OH)3 кислотні ознаки практично не проявляються. Таким чином, в цьому ряду чітко спостерігається посилення основних і послаблення кислотних ознак, що корелюється із збільшенням розмірів атому Ме (ІІІ). Разом з тим відомий TlOH проявляє властивості лугів, що теж вказує на збільшення основного характеру для сполук з меншим ступенем окиснення того ж самого елементу.
Гідроксиди елементів IV групи (с.о. елементу +4) неможливо виділити в індивідуальному стані, оскільки при їх одержанні практично утворюються білі студенисті осади змінного складу Мe O2× n H2O. Свіжовиготовлені гідроксиди Стануму та Плюмбуму проявляють амфотерні властивості: розчиняються в кислотах і лугах (в останньому випадку утворюються сполуки складу Na2[ Me (OH)6]). Оксиди і гідроксиди елементів із с.о. +2 – амфотерні, причому в Ge(OH)2 переважають кислотні властивості, а у Pb(OH)2 – основні.
Із вищих гідроксидів V групи (с.о. елементу +5) у вільному вигляді одержана тільки арсенатна кислота H3AsO4 – тверда, розчинна у воді речовина. При спробі одержати стибіатної кислоти утворюється осад невизначеного складу Sb2O5× nH2O. Бісмутатна кислота також не виділена.
Одержання: Гідроксиди утворюються при взаємодії лужних металів або їх оксидів з водою. В промисловості гідроксиди натрію та калію одержують електролізом розчинів хлоридів:
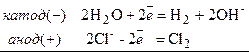
2Cl–+2Н2О  Н2+2ОН–+Cl2 або 2NaCl+2Н2О
Н2+2ОН–+Cl2 або 2NaCl+2Н2О  Н2+2NaОН+Cl2
Н2+2NaОН+Cl2
Амфотерні гідроксиди одержують при дії аміаку на розчини відповідних солей:
AlCl3+3NH3+3H2O = Al(OH)3¯ +3NH4Cl
SnCl4+4NH3+6H2O = H2[Sn(OH)6]¯ +4NH4Cl
Нерозчинні у воді гідроксиди р -металів одержують обмінними реакціями солей з лугами:
Bi(NO3)3+3KOH = Bi(OH)3¯ +3KNO3
або при дії кислот на аніонні похідні:
Na[Sb(OH)6]+HCl = NaCl+Sb(OH)3¯ +H2O
Солеподібні бінарні сполуки лужних та лужноземельних металів – гідриди, бориди, карбіди, нітриди розкладаються водою:
KH + H2O = KOH + H2, BeH2 + 2H2O = Be(OH)2 + H2
K3N + 3H2O = 3KOH + NH3, Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3
K2C2 + 2H2O = 2KOH + C2H2 CaC2 + 2H2O = Ca(OH)2 + C2H2
Солі лужних та лужноземельних металів – тверді кристалічні речовини білого кольору, переважно стійкі до нагрівання, за винятком нітратів: 2NaNO3  2NaNO2+O2,
2NaNO2+O2,
| Важливіші сполуки |
Ca(NO3)2  Ca(NO2)2 + O2
Ca(NO2)2 + O2
Карбонати металів ІІ групи розкладаються при прожарюванні: BaCO3  BaO+CO2,
BaO+CO2,
карбонати металів І групи не розкладаються, окрім Li2CO3  Li2O+CO2
Li2O+CO2
Водні розчини солей лужних та лужноземельних металів з аніонами слабких кислот мають лужну реакцію внаслідок гідролізу, наприклад: Na2CO3+H2O Û NaHCO3+NaOH.
Солі берилію і барію отруйні.
Сполуки р- елементів ІІІ групи з водних розчинів завжди виділяються у вигляді кристалогідратів, напнриклад Ме Cl3× 6H2O, K Me (SO4)2× 12H2O (галуни). Аквакомплекси Алюмінію, Галію, Індію безбарвні, Талію – слабо жовтого кольору. Водні розчини солей сильних кислот мають кислу реакцію внаслідок гідролізу
Me 3++HOH Û Me OH2++H+
Солі слабих кислот гідролізують необоротньо, наприклад:
Al2S3+6H2O = 2Al(OH)3¯ +3H2S
Аl, Ga, In з р -елементами V групи утворюють алмазоподібні сполуки типу AIIIBV (GaAs, InSb, TlBi), більшість яких є напівпровідниками.
Для Германію й Стануму найхарактерніші ступені окиснення +4, тому сполуки Ge(ІІ) і Sn(ІІ) є сильними відновниками:
GeCl2+Cl2= GeCl4; SnCl2+Cl2= SnCl4
2Bi(NO3)3+3Na[Sn(OH)3]+9NaOH = 2Bi¯ +3Na2Sn(OH)6]+6NaNO3
В той же час для плюмбуму більш характерний ступінь окиснення +2, тому сполуки плюмбуму(ІУ) є сильними окисниками.
5  SO4+2KMnO4+8H2SO4 =5
SO4+2KMnO4+8H2SO4 =5  (SO4)2+2MnSO4+K2SO4+8H2O
(SO4)2+2MnSO4+K2SO4+8H2O
SnCl2 + Cl2 = SnCl4
5  O2+2Mn(NO3)2+6HNO3 = 5
O2+2Mn(NO3)2+6HNO3 = 5  (NO3)2+2HMnO4+2H2O
(NO3)2+2HMnO4+2H2O
PbO2 + 4HCl = PbCl2 + Cl2 + 2H2O
Сполуки Стибію та Бісмуту в розчинах оборотньо гідролізують з утворенням малорозчинних основних солей: SbCl3+H2O = SbOCl + 2НСl; SbCl5 + H2O = SbOCl3 + 2НСl,
чим пояснюється їх відносно низька токсичність.
Сполуки As(III), Sb(III) є відновниками.
SbCl3 + Cl2 = SbCl5
Окиснювальні властивості характерні для бісмутатів:
2Mn(NO3)2+5Na 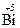 O3+16HNO3 = 2HMnO4+5
O3+16HNO3 = 2HMnO4+5  (NO3)3+5NaNO3+7H2O
(NO3)3+5NaNO3+7H2O
Сполуки Tl(III) – сильні окисники.
В якості солеподібних сполук, в яких As, Sb, Bi проявляють ступінь окиснення –3, модна розглядати арсеніди, стибіди і бісмутіди s -елементів (K3Sb, Ca3As2).
Посилення металічних властивостей в ряду As–Sb–Bi проявляється також в зміні стійкості солей сполук Е(ІІІ): Солі As(III) нестійкі і у вільному стані не виділені, тоді як для Sb(ІІІ) відомі сульфат та нітрат, тоді як солі Bi(ІІІ) численні і різноманітні.
| Якісні реакції на елементи |
Солі лужних та лужно-земельних металів забарвлюють полум’я у різні кольори: K – у фіалковий, Na – в жовтий, Li – у червоний, Са –у цегляний, Sr – в малиновий, Ba – синьо-зелений.
Mg виявляють по утворенню білого осаду подвійної солі в реакції
MgSO4+Na2HPO4+NH4OH = MgNH4PO4¯ +Na2SO4 + H2O,
осад розкладається при прожарюванні: 2MgNH4PO4  Mg2P2O7 + 2NH3 + H2O.
Mg2P2O7 + 2NH3 + H2O.
Ва та Са виявляють по утворенню осадів при дії сульфатної кислоти на їх солі:
Ba2++SO42- = BaSO4¯,
Ca2++SO42-+2H2O = CaSO4 × 2 H2O¯.
Sn4+-іон при взаємодії з сірководнем дає оранжевий осад, розчинний у сульфіді натрію:
Sn4+ + 2H2S = 4H+ + SnS2¯, SnS2 + Na2S = Na2SnS3.
Sn2+-іон при взаємодії з сірководнем дає бурий осад, який розчиняється дисульфідом натрію:
Sn2+ + H2S = 2H+ + SnS¯, SnS + Na2S2 = Na2SnS3.
Pb2+-іон при взаємодії з сірководнем дає бурий осад:
Pb2+ + H2S = 2H+ + PbS¯.
Al3+-іон при дії лугів утворює білий осад, розчинний у надлишку лугу:
Al3+ + 3OH– = Al(OH)3¯, Al(OH)3 + KOH = K[Al(OH)4].
| Використання |
Літій іде на виробництво хімічних джерел струму (акумулятори). Промислове значення мають сполуки натрію: кам’яна або кухонна NaCl – у консервній промисловості та як сировина для виробництва інших сполук, у вигляді ізотонічного (фізіологічного) 0, 9%-го розчину використовується у медицині; каустична сода NaOH використовується при переробці бокситів, виробництві штучних волокон, очистці нафти, миловарінні, добуванні інших сполук натрію; сода Na2CO3 використовується у виробництві скла, миловарінні; питну соду NaНCO3 у медицині використовують для зниження кислотності шлункового соку при ацидозах; металічний натрій використовують для добування інших металів (металотермія) (наприклад, TiCl4 + 4Na = 4NaCl + Ti); сплав натрію та калію, рідкий за кімнатної температури, використовують для відводу тепла від ядерних реакторів.
Сполуки калію переважно використовуються як мінеральні добрива. У медицині застосовують хлорид калію KСl при серцевій дистрофії, для відновлення вмісту калію в організмі, при важких інтоксикаціях. Використовують як лікарські препарати також бромід та йодид калію (антиструмін).
Цезій використовують для поглинання залишків газів у високовакуумних приладах та у фотоелементах.
Магній та кальцій використовують при одержанні інших металів (металотермія): V2O5+5Ca=5CaO + 2V.
Берилій та магній використовують у вигляді сплавів Широке використання знайшли сплави берилію з міддю та магнію з алюмінієм, цинком, марганцем (берилієві бронзи, електрон). Промислове значення мають сполуки кальцію: CaCO3 (мармур, вапняк) як будівельний матеріал, а також як сировина для виробництва цементу, скла, вапна, гіпсу; СаО (негашене вапно); Са(ОН)2 (гашене вапно).; СаС2 (карбід) У медичних цілях використовується гіпс CaSO4× 2H2O для іммобілізації кінцівок при переломах, хлорид та глюконат кальцію як протиалергічний та протизапальний препарат, карбонат кальцію (зубна паста).
Сполуки магнію використовуються у медицині як протисудомне, при гіпертонії. Сульфат магнію вживають як послаблююче. Силікат магнію (тальк) використовують як присипку та основу для мазей, оксид – при печії, виразці шлунку.
Пероксид барію використовують для промислового добування гідрогенпероксиду:
BaO2 + H2SO4 = BaSO4 + H2O2.
У медицині використовують нерозчинний сульфат барію як контрастну речовину при рентгенографії кишечника.
Металічний алюміній широко використовується в промисловості. Основна його маса йде на приготування сплавів: дюралюміній (алюміній+мідь(1, 4–13 %))– конструкційний матеріал в авіа- та машинобудуванні, магналін (алюміній+магній(5–13 %)) – конструкційний матеріал в суднобудуванні, силумін (алюміній+кремній) – конструкційний матеріал в автомобіле-, авіа-, машинобудуванні, виробництві точних приладів. Використовують в металургії при виплавленні сплаві та для алюмотермічного одержання багатьох иетплів (кальцію, літію, барю, марганцю, хрому). Суміш оксидів алюмінію та заліза (має назву терміт) використовується для зварювання стальних виробів. З алюмінію виготовляють фольгу, проводи, фарбу “під срібло”, виробляють предмети побуту. Кристалічний оксид алюмінію (корунд) є абразивним матеріалом, деякі його різновиди (рубін, сапфір) є коштовними каміннями. Алюмокалієві галуни використовують для дублення шкір, як протрава при фарбуванні тканин, у виробництві паперу, медицині, фотографії.
Індій, галій і талій використовують для одержання легкоплавких сплавів та одержання напівпровідникових матеріалів.
Сполуки талію отруйні, їх використовують в сільському господарстві як пестициди.
Германій та його сполуки використовують для виготовлення напівпровідникових приладів, скловолокна.
Олово входить до складу багатьох практично важливих сплавів: бронзи (Sn+Cu), бабіту (Sn+Sb), легкоплавкого припою (Sn+Pb). Олово застосовують для нанесення захисних покрить (лудіння заліза).
На основі свинцю виробляють сплави, які використовують як матеріал для підшипників (Pb+Sb+Cu), друкарського шрифту (Pb+Sn+Sb+As). З свинцю виготовляють електроди для акумуляторів, оболонки для кабелів, свинцеві вироби служать захистом від радіоактивного випромінювання. Сполуки плюмбуму є складовою частиною фарб, кришталю, оптичного скла й емалей.
Арсен, стибій і бісмут використовують для виробництва сплавів. Деякі їх сполуки мають напівпровідникові властивості, їх використовують у електронній техніці. Сполуки цих металів отруйні. Їх використовують як пестициди та інсектициди.
| Твердість води та її усунення |
У природній воді (за винятком дощової) містяться солі натрію, кальцію, магнію у вигляді гідрокарбонатів, хлоридів та сульфатів. Вода з високим вмістом солей магнію та кальцію називається твердою, а з низьким – м’якою водою. Вміст у воді кальцію та магнію у вигляді хлоридів і сульфатів визначає постійну твердість води. Розчинні гідрокарбонати кальцію та магнію визначають тимчасову твердість води.
Оскільки вода з високим вмістом солей Кальцію та Магнію обмежено придатна до використання у господарській діяльності людини, її необхідно пом’якшувати. При цьому воду обробляють реагентами, які осаджують кальцій та магній у вигляді нерозчинних солей, замінюючи їх на натрій.
Усунення тимчасової твердості води:
1. При кип’ятінні води розчинні гідрокарбонати кальцію та магнію руйнуються і нерозчинні карбонати випадають в осад: 2Ca(HCO3)2  CaCO3 + H2O + CO2.
CaCO3 + H2O + CO2.
У промисловій водопідготовці даний спосіб не використовується як енергозатратний.
2. При додаванні до твердої води вапна Ca(OH)2 протікає його взаємодія з гідрокарбонатами, що призводить до випадання осаду карбонатів: Ca(OH)2 + Ca(HCO3)2 = 2CaCO3 + 2H2O.
Усунення постійної твердості води:
При усуненні постійної твердості води усувається і тимчасова.
1. Тимчасова твердість усувається повністю і частково постійна при обробці води каустичною содою NaOH: 2NaOH + Ca(HCO3)2 = CaCO3 + Na2CO3 + 2H2O,
причому карбонат натрію зв’язує частину іонів магнію: Na2CO3 + MgSO4 = MgCO3 + Na2SO4.
2. При обробці води сумішшю соди з каустичною содою твердість води усувається повністю.
3. Ще більш ефективно діє як пом’якшуючий засіб фосфат натрію, який додають у пральні порошки: 3MgSO4 + 2Na3PO4 = Mg3(PO4)2 + 3Na2SO4.
4. При пом’якшенні великої кількості води у промисловості користуються іонообмінними смолами. Іонообмінні смоли – полімери, до складу молекул яких входять функціональні групи, здатні утримувати катіони (катіоніти) або аніони (аніоніти).
Використовують для пом’якшення води катіоніти, переважно сульфовугілля (катіоніт КУ-1). При пропусканні твердої води через колонку, заповнену натрієвою сіллю катіоніту, іони кальцію та магнію реагують з катіонітом і утримуються його функціональними групами, заміщуючи натрій.
Тестові завдання:
1. Як одержати Be(OH)2 маючи Be, KOH і H2O, напишіть рівняння реакції.
2. Як одержати Ca(HCO3)2 маючи Ca, CO2 і H2O, напишіть рівняння реакції.
3. Написати рівняння хімічних реакцій, необхідних для проведення перетворень:
а) K → KOH → KHCO3 → K2CO3 → KCl → KNO3 → KNO2
б) NaCl → Na → NaOH → Na2SO4 → BaSO4
в) Na2O2 → O2 → Li2O → LiCl → Li → LiNO3
г) Na2CO3 → NaHCO3 → CO2 → CaCO3 → CaO → Ca(OH)2
д) KNO3 → KNO2 → KCl → K → KOH → KClO3
е) NaCl → Na → NaOH → NaCl → Na2SO4
ж) Na2O → NaOH → Na2CO3 → Na2SiO3 → NaCl
з) Na2CO3 → CO2 → CaCO3 → Ca(HCO3)2 → CO2 → NaHCO3
і) Ca → Ca(OH)2 → CaCO3 → Ca(HCO3)2 → CaCl2 → Ca(NO3)2
к) BeCl2 → Be → BeO → Be(OH)2 → BeCO3 → Be(HCO3)2 → BeCO3 → BeCl2
л) Mg → MgO → MgCl2 → MgCO3 → MgO → Mg(NO3)2
м) Be → BeO → Be(OH)2 → Be(NO3)2 → NaNO3 → NaNO2
н) Ca → Ca(OH)2 → CaCO3 → CaO → CaCl2 → Ca3(PO4)2 → Ca(H2PO4)2
4. Скласти молекулярні рівняння, за допомогою яких можна здійснити перетворення за такими схемами:
а) Mg2+→ Mg0→ Mg2+→ Mg(OH)2→ MgSO4→ Mg(NO3)2
б) Ca0→ Ca2+→ Ca0→ CaH2→ Ca(OH)2→ Ca(NO3)2→ CaO→ CaC