
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Газові закони
|
|
Багато хімічних процесів відбуваються в газовій фазі, тому більшість методів визначення молярних мас сполук засновані на використанні газових законів.
Моль – кількість речовини, яка містить стільки атомів, молекул, іонів, електронів або інших структурних одиниць, скільки атомів міститься в 12 г ізотопу 12C. Число структурних одиниць, яке міститься в 1 молі речовини (стала Авогадро), дорівнює 6, 02.1023 моль− 1.
Масу 1 моля речовини називають молярною або мольною масою; вона виражається в г/моль і чисельно дорівнює відносній молекулярній або атомній масі речовини. Кількість молей n розраховується за формулою n = m/M, де m - маса речовини, М - молярна маса. Наприклад, в 1 молі речовини кисню O2 і елемента Оксигену міститься одна і та ж кількість структурних одиниць – в першому випадку 6, 02.1023 молекул O2, в другому - 6, 02.1023 атомів O. Але мольна маса O2 дорівнює 32 г/моль, а маса 1 моля атомів O - 16 г/моль.
Стан газу характеризується його тиском, температурою і об’ємом. Зв’язок між ними встановлюють закони ідеальних газів. Ідеальні гази – такі системи, в яких можна нехтувати розмирами частин і взаємодією між ними. До ідеальних наближаються більшість низькомолекулярних газів за звичайних умов – Н2, О2, N2, CO2, повітря.
Одним з основних газових законів, що використовується в хімії є закон Авогадро: в рівних об’ємах різних газів за однакових умов (тиску і температурі) міститься однакова кількість молекул.
Закон Авогадро має два наслідки:
1. Молярна маса газу або пари дорівнює добутку відносної густини даного газу за іншим та молярної маси іншого газу. Відносною густиною першого газу за другим (D 2) називається відношення мас однакових об’ємів першого газу і другого газу за однакових умов, тобто
D 2 = m 1/ m 2 = nМ 1/ nМ 2 = M 1/ M 2; M 1 = D 2/ M 2.
Найчастіше відносна густина визначається за воднем або за повітрям:
М 1 = D Н2. М (Н2) = 2 D Н2; М 1 = D пов. M (пов) = 29 D пов; (М (пов) = 29 г/моль).
2. Один моль будь-якого газу за нормальних умов займає об’єм 22, 416 л. Цей об’єм називають молярним об’ємом газу.
Нормальні умови (0) – Т 0 = 273 К, Р 0 = 101325 Па.
Параметри стану газу Р, V, Т пов’язані з його масою m і молярною масою М в законі Менделєєва-Клапейрона:
РV = (m / M) RT,
де R - універсальна газова стала, яка визначається для 1 моля газу з виразу:
R = P 0 V 0/ T 0
В залежності від використаних одиниць R має різні чисельні значення:
R = 8, 31 Дж/(моль.К) (Система Інтернаціональна - СІ) = 0, 0821 л . атм/(моль.К) = 62360 мл . мм рт.ст./(моль. К) = 1, 987 кал/(моль. К).
Молярну масу газоподібних речовин можна визначити наступними способами:
а) Визначення молярної маси за відносною густиною.
Приклад 1. Визначити молярну масу газу, якщо 1, 5 г цього газу за однакових Р і Т займають той самий об’єм, що й 0, 1 г водню.
Розв’язання:
1. D Н2-?
D Н2 = m (газ)/ m (H2) = 1, 5/0, 1 = 15.
2. М (газ) -?
Використовуючи наслідок з закону Авогадро, запишемо:
М (газ) = 2 D Н2= 2.15 = 30 г/моль.
Відповідь: молярна маса газу дорівнює 30 г/моль.
Приклад 2. Визначити густину за воднем газової суміші, яка складається з 50 % кисню та 50 % водню за об’ємом.
Розв’язання:
1. М (суміші) -?
Об’ємна частка дорівнює мольній частці, тому молярну масу суміші можна розрахувати за формулою:
М (суміші) = М 1 N 1 + М 2 N 2 = М (О2). N (О2) + М (Н2) . N (Н2), де N (H2) i N (O2) – мольні долі газів у суміші; М (суміші) = 32.0, 5 + 2.0, 5 =17(г/моль).
2. D Н2-?
D Н2= М (суміші)/ М (Н2) =17/2 = 8, 5
Відповідь: густина суміші за воднем дорівнює 8, 5.
б) Визначення молярної маси за мольним об’ємом.
Приклад 3. Визначити молярну масу газу, якщо маса 600 мл його дорівнює 1, 714 г за н.у.
Розв’язання:
1. М (газ) -? Використовуючи наслідок з закону Авогадро, складаємо пропорцію:
1, 714 г газу займають об’єм 600 мл;
х г газу займають об’єм 22400 мл;
х = (22400 . 1, 714)/600 = 63, 9 г.
Оскільки 22400 мл це – мольний об’єм газу, М (газ) = 63, 9 г/моль.
Відповідь: М (газ) = 63, 9 г/моль.
в) Визначення молярної маси газу за законом Менделєєва-Клапейрона.
Приклад 4. Визначити молярну масу бензену, якщо маса 600 мл його пари при 87 °С і тиску 83, 2 кПа дорівнює 1, 30 г.
Розв’язання:
Виразимо всі дані в одиницях СІ:
Р = 8, 32 104 Па; Т = 273 + 87 = 300 К; V = 6 10− 4 м3; m = 1, 3 10− 3 кг.
1. М (С6Н6) -?
Використовуємо закон Менделєєва-Клапейрона: РV = (m / M). RT,
звідки

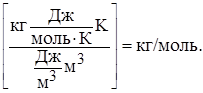
Відповідь: молярна маса бензолу дорівнює 78 г/моль.