
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Второе начало термодинамики
|
|
Статистическая физика
Функция распределения. Будем исходить из того, что элементарные представления о случайной величине и вероятности имеются. Пусть случайная величина х непрерывна. Разобьем всю область изменения х на достаточно большое число интервалов, и будем считать число попаданий величины х в тот или иной интервал. Пусть нам известна вероятность Рх попадания в тот или иной интервал Δ x. Величина Δ Рх - это приращение Рх, соответствующее данному Δ x. Отношение начиная с некоторого достаточно малого Δ x перестает зависеть от величины Δ x и тогда оно может служить характеристикой случайной величины. В пределе при Δ x→ 0 указанное отношение называется функцией распределения
 . (27)
. (27)
 Из определения (27) следует, что
Из определения (27) следует, что  является плотностью вероятности. На рис.8 представлена одна из возможных
является плотностью вероятности. На рис.8 представлена одна из возможных  , где площадь заштрихованной полоски равна вероятности
, где площадь заштрихованной полоски равна вероятности  того, что случайная величина х окажется в интервале от х до х + dx:
того, что случайная величина х окажется в интервале от х до х + dx:
 =
=  . (28)
. (28)
Вероятность того, чтовеличина х попадет в интервал от а до b равна
 . (29)
. (29)
Вероятность того, что случайная величина примет любое значение в пределах области определения, очевидно, равна 1:
 . (30)
. (30)
Это условие нормировки. Таким образом, вся площадь под кривой на рис.8 равна 1.
Средние значения. Среднее значение х можно найти по известной функции распределения:
 . (31)
. (31)
Аналогично, можно найти среднее любой функции φ (х), например, пусть φ (х)= х 2:
 . (32)
. (32)
Распределение Максвелла. Хаотически движущиеся молекулы газа имеют самые различные скорости. Некоторые скорости (например, очень большие, или близкие к 0) встречаются редко, а другие более часто. Так как энергия (Þ и скорость) теплового движения зависит от температуры, для каждой температуры существует скорость, которую мы встретим чаще всего. Каждому значению скорости отвечает своя частота появления, в пределе вероятность. Иными словами, молекулы газа распределены по скоростям. Это распределение было получено Максвеллом в 1859 году примерно следующим образом.
Введем пространство скоростей, где по осям вместо координат x, y, z обычного декартова пространства изобразим проекции скоростей: υ x, υ y, υ z. Тогда скорости каждой из N молекул в этом пространстве будет соответствовать точка - конец вектора  , идущего из начала координат. Вследствие равноправности всех направлений распределение точек относительно начала координат должно быть сферически симметричным. Поэтому плотность точек будет зависеть от модуля скорости υ. Выделим в некоторой точке – конце вектора
, идущего из начала координат. Вследствие равноправности всех направлений распределение точек относительно начала координат должно быть сферически симметричным. Поэтому плотность точек будет зависеть от модуля скорости υ. Выделим в некоторой точке – конце вектора  - малый объем dυ xdυ ydυ z (рис.9, ось z – на нас), в котором содержится достаточно большое (~104) количество молекул dN, но малое по сравнению с N (~1023). Вероятность dP (υ x, υ y, υ z) того, что конец вектора
- малый объем dυ xdυ ydυ z (рис.9, ось z – на нас), в котором содержится достаточно большое (~104) количество молекул dN, но малое по сравнению с N (~1023). Вероятность dP (υ x, υ y, υ z) того, что конец вектора  попадет в этот объем, запишем с помощью неизвестной функции
попадет в этот объем, запишем с помощью неизвестной функции  , зависящей только от модуля скорости из-за упомянутой выше сферической симметрии:
, зависящей только от модуля скорости из-за упомянутой выше сферической симметрии:

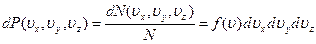 . (33)
. (33)
Вероятность того, что молекула будет иметь проекцию скорости в интервале  , есть
, есть
 , (34)
, (34)
где  - функция распределения только по одной проекции,
- функция распределения только по одной проекции,  . Вероятности попадания каждой проекции скорости в свой интервал – это вероятности независимых событий. Поэтому вероятность попадания точки в наш кубик (т.е. вероятность dP (υ x, υ y, υ z) того, что одновременно три проекции скорости окажутся в интервалах
. Вероятности попадания каждой проекции скорости в свой интервал – это вероятности независимых событий. Поэтому вероятность попадания точки в наш кубик (т.е. вероятность dP (υ x, υ y, υ z) того, что одновременно три проекции скорости окажутся в интервалах  ;
;  ;
;  ) равна произведению вероятностей в соответствии с теоремой об умножении вероятностей независимых событий:
) равна произведению вероятностей в соответствии с теоремой об умножении вероятностей независимых событий:
 . (35)
. (35)
Из соображений равноправия осей υ x, υ y, υ z функции φ должны быть одинаковыми функциями своих проекций. С учетом нормировки, такими функциями являются:

 . (36)
. (36)
Аналогичными функциями являются  ,
,  . Сравнивая (33) и (35), находим
. Сравнивая (33) и (35), находим  . Отсюда
. Отсюда
 . (37)
. (37)
График функции  - это гауссова кривая (рис. 10). Площадь заштрихованной полоски равна вероятности того, что проекция скорости молекулы лежит в интервале
- это гауссова кривая (рис. 10). Площадь заштрихованной полоски равна вероятности того, что проекция скорости молекулы лежит в интервале  . Аналогично выглядят функции
. Аналогично выглядят функции  и
и  . Каждая из трех функций
. Каждая из трех функций  нормирована на 1, т.е. площадь под кривой в пределах от -∞ до +∞ равна 1.
нормирована на 1, т.е. площадь под кривой в пределах от -∞ до +∞ равна 1.
Найдем теперь вероятность того, что модуль скорости молекул заключен в интервале  . Таким молекулам в пространстве скоростей соответствуют точки, попадающие в шаровой слой между сферами радиусов
. Таким молекулам в пространстве скоростей соответствуют точки, попадающие в шаровой слой между сферами радиусов  и
и  (рис.11). Объем этого слоя равен произведению площади поверхности слоя (4 pυ 2) на его толщину (4 pυ 2 dυ). Для всех точек внутри слоя объемная плотность вероятности
(рис.11). Объем этого слоя равен произведению площади поверхности слоя (4 pυ 2) на его толщину (4 pυ 2 dυ). Для всех точек внутри слоя объемная плотность вероятности  одинакова из-за сферической симметрии. Следовательно, вероятность попадания в этот слой
одинакова из-за сферической симметрии. Следовательно, вероятность попадания в этот слой
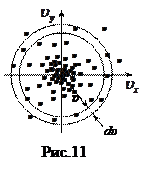
 . (38)
. (38)
Искомая плотность вероятности  , где
, где  подставим из (37):
подставим из (37):
 . (39)
. (39)
 Это распределение Максвелла по модулю скорости. Вид функции F (υ) представлен на рис.12. Так как кривая F (υ) не симметрична, три характерные скорости: наивероятнейшая
Это распределение Максвелла по модулю скорости. Вид функции F (υ) представлен на рис.12. Так как кривая F (υ) не симметрична, три характерные скорости: наивероятнейшая  , средняя < υ > и среднеквадратичная υ кв не совпадают. Наивероятнейшей скорости соответствует максимум функции F (υ), поэтому найдем
, средняя < υ > и среднеквадратичная υ кв не совпадают. Наивероятнейшей скорости соответствует максимум функции F (υ), поэтому найдем  , приравняв производную нулю:
, приравняв производную нулю:  , после чего получим
, после чего получим
 . (40)
. (40)
Средняя скорость по определению среднего равна
 . (41)
. (41)
Среднеквадратичная скорость находится из определения среднего квадрата скорости
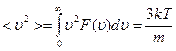 , Þ
, Þ  ,
,  . (42)
. (42)
Например, средняя скорость молекул азота при комнатной температуре ~480 м/с.
Рассмотрим зависимость формы распределения Максвелла от температуры. Подставив значение наивероятнейшей скорости (40) в (39), получим
 . (43)
. (43)
В соответствии с (43) и (40) по мере роста температуры Т максимум кривой будет сдвигаться вправо, а его величина уменьшаться. Следовательно, по мере роста температуры скорости будут менее тесно группироваться вокруг наивероятнейшей.
Формула распределения Максвелла в приведенном виде. Введем относительную скорость
 , тогда υ = uυ вер =
, тогда υ = uυ вер =  , Þ
, Þ  ,
,
подставляя два последних выражения в (39), получим распределение по безразмерной относительной скорости u:
 . (44)
. (44)
В таком виде распределение не зависит ни от массы молекул газа, ни от температуры.
Распределение Максвелла по кинетическим энергиям молекул. Найдем распределение молекул по их кинетическим энергиям поступательного движения 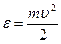 . Поскольку вероятность наличия у молекулы скорости в интервале
. Поскольку вероятность наличия у молекулы скорости в интервале 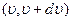 равна
равна  , то разделив и умножив правую часть этого равенства на dε, получим
, то разделив и умножив правую часть этого равенства на dε, получим
 . (45)
. (45)
Учтем, что 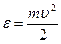 ; Þ
; Þ  . Подставим в F (υ) квадрат скорости
. Подставим в F (υ) квадрат скорости 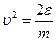 и в (45)
и в (45)  :
:

 . (46)
. (46)
 Распределение Больцмана. В отсутствие внешних сил средняя концентрация молекул системы в состоянии равновесия всюду одинакова. Если газ находится во внешнем силовом поле, то все молекулы испытывают действие сил со стороны этого поля и поэтому стремятся занять положение с минимумом потенциальной энергии. Однако далеко не все молекулы могут это сделать, потому, что хаотическое тепловое движение стремится разбросать молекулы по объему системы более-менее равномерно. В результате возникает некоторое распределение молекул по концентрациям вдоль линий действия поля. Это распределение мы и будем искать. Пусть газ находится во внешнем потенциальном поле, силы которого направлены вертикально вниз. Направим ось z вертикально вверх (рис.13). Выделим в толще газа вертикальный столб сечением
Распределение Больцмана. В отсутствие внешних сил средняя концентрация молекул системы в состоянии равновесия всюду одинакова. Если газ находится во внешнем силовом поле, то все молекулы испытывают действие сил со стороны этого поля и поэтому стремятся занять положение с минимумом потенциальной энергии. Однако далеко не все молекулы могут это сделать, потому, что хаотическое тепловое движение стремится разбросать молекулы по объему системы более-менее равномерно. В результате возникает некоторое распределение молекул по концентрациям вдоль линий действия поля. Это распределение мы и будем искать. Пусть газ находится во внешнем потенциальном поле, силы которого направлены вертикально вниз. Направим ось z вертикально вверх (рис.13). Выделим в толще газа вертикальный столб сечением 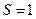 , а в этом столбе выделим горизонтальный слой толщиной dz на высоте z, где давление равно р. Учитывая действие сил поля вниз, можно утверждать, что с высотой давление уменьшается, Þ р> p+dp (давление на высоте z + dz), Þ dp < 0. Запишем условие равновесия выделенного слоя:
, а в этом столбе выделим горизонтальный слой толщиной dz на высоте z, где давление равно р. Учитывая действие сил поля вниз, можно утверждать, что с высотой давление уменьшается, Þ р> p+dp (давление на высоте z + dz), Þ dp < 0. Запишем условие равновесия выделенного слоя:
 ,
,
где  , как проекция силы потенциального поля. Следовательно,
, как проекция силы потенциального поля. Следовательно,  . Считая газ идеальным, можно положить
. Считая газ идеальным, можно положить 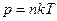 , Þ
, Þ  , Þ
, Þ  , или
, или 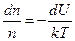 . Проинтегрируем:
. Проинтегрируем: 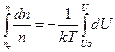 , Þ
, Þ  , Þ считая, что при n = n o потенциальная энергия Uo =0, окончательно получим распределение Больцмана
, Þ считая, что при n = n o потенциальная энергия Uo =0, окончательно получим распределение Больцмана
 . (47)
. (47)
Барометрическая формула. Рассмотрим изотермическую атмосферу в однородном поле сил тяжести Земли не слишком высоко от поверхности. В этом поле потенциальная энергия молекулы массой m на высоте h равна  , поэтому распределение Больцмана принимает вид
, поэтому распределение Больцмана принимает вид
 . (48)
. (48)
Поскольку 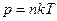 , Þ p~ n, Þ получим барометрическую формулу
, Þ p~ n, Þ получим барометрическую формулу
 . (49)
. (49)
Умножив числитель и знаменатель в показателе экспоненты на число Авогадро, получим
 , (50)
, (50)
еще одно выражение для барометрической формулы. Существенное замечание: при выводах мы предполагали, что температура не зависит от высоты, т.е. использовали модель изотермической атмосферы. На самом деле температура заметно уменьшается с высотой, учет чего сложен. Отсюда выясняется область применимости барометрической формулы: она оценивает уменьшение давления в пределах высот, на которых температура падает несущественно.
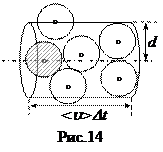 Средняя длина свободного пробега молекул. Длиной свободного пробега λ называется расстояние, которое молекула пробегает между двумя последовательными столкновениями. Поскольку у молекул существует распределение по скоростям, то и длина свободного пробега может у разных молекул быть различной. Поэтому логично ввести среднюю длину свободного пробега < λ >. Рассмотрим движение одной (тонированной на рис.14) молекулы. За время Dt эта молекула пролетит расстояние < u> Dt и столкнется со всеми молекулами, центры которых отстоят от ее траектории на расстояниях не больших, чем диаметр молекулы d. Другими словами, эта молекула столкнется со всеми молекулами, центры которых лежат внутри цилиндра радиуса d (и площадью основания pd 2) и высоты < u> Dt. Если концентрация молекул n, то внутрь цилиндра попадет их количество, равное произведению концентрации на объем цилиндра n p d 2 < u> Dt. Именно такое количество столкновений < n> в среднем молекула испытает за время Dt: < n> = n p d 2 < u> Dt. Поскольку другие молекулы тоже движутся, то вместо средней скорости < u> в последнюю формулу следует поставить среднюю относительную скорость их движения, которая равна
Средняя длина свободного пробега молекул. Длиной свободного пробега λ называется расстояние, которое молекула пробегает между двумя последовательными столкновениями. Поскольку у молекул существует распределение по скоростям, то и длина свободного пробега может у разных молекул быть различной. Поэтому логично ввести среднюю длину свободного пробега < λ >. Рассмотрим движение одной (тонированной на рис.14) молекулы. За время Dt эта молекула пролетит расстояние < u> Dt и столкнется со всеми молекулами, центры которых отстоят от ее траектории на расстояниях не больших, чем диаметр молекулы d. Другими словами, эта молекула столкнется со всеми молекулами, центры которых лежат внутри цилиндра радиуса d (и площадью основания pd 2) и высоты < u> Dt. Если концентрация молекул n, то внутрь цилиндра попадет их количество, равное произведению концентрации на объем цилиндра n p d 2 < u> Dt. Именно такое количество столкновений < n> в среднем молекула испытает за время Dt: < n> = n p d 2 < u> Dt. Поскольку другие молекулы тоже движутся, то вместо средней скорости < u> в последнюю формулу следует поставить среднюю относительную скорость их движения, которая равна  . Таким образом, среднее число столкновений равно < n> =
. Таким образом, среднее число столкновений равно < n> =  n p d 2 < u> Dt. Если мы на эту величину разделим расстояние < u> Dt, то и получим среднюю длину свободного пробега:
n p d 2 < u> Dt. Если мы на эту величину разделим расстояние < u> Dt, то и получим среднюю длину свободного пробега:
 , или
, или
 . (51)
. (51)
На самом деле, предположение о молекулах как об упругих шариках излишне примитивно. Столкновение в масштабах молекул представляет собой сложный комплекс взаимодействий не только и не столько механической природы. Поэтому величина d в формуле (51) представляет собой «эффективный диаметр», т.е. минимальное расстояние, на которое сближаются центры двух молекул. Экспериментально проще измерить < λ >, и тогда из формулы (51) можно найти эффективный диаметр:
 . (52)
. (52)
Уравнение переноса. Если система находится в неравновесном состоянии, то даже без внешнего воздействия параметры ее состояния будут меняться со временем и в различных частях самой системы, т.е. в её объеме. Процессы, связанные с переносом физических величин в объеме вещества, называют явлениями переноса. К явлениям переноса относятся диффузия (перенос массы), теплопроводность (перенос внутренней энергии), внутреннее трение (перенос импульса).
Все перечисленные явления переноса в своей основе описываются похожими уравнениями. Поэтому можно рассмотреть сначала математическую основу явлений переноса абстрактно, т.е. не вдаваясь в подробности конкретного явления. Пусть вдоль оси х может переноситься некоторая физическая величина А. Это значит, производная  . Подсчитаем число N молекул, пересекающих за время Dt площадку S, перпендикулярную оси х.
. Подсчитаем число N молекул, пересекающих за время Dt площадку S, перпендикулярную оси х.
 Это число равно числу молекул в параллелепипеде на рис.15, при условии, что они летят вдоль ох со средней скоростью < u>:
Это число равно числу молекул в параллелепипеде на рис.15, при условии, что они летят вдоль ох со средней скоростью < u>:  . Единицу площади за единицу времени пересекают
. Единицу площади за единицу времени пересекают  молекул. Наличие явления переноса означает, что молекулы, летящие вправо, и молекулы, летящие влево, имеют разные А. В итоге, мерой М (А) переноса величины А служит разность величин, переносимых влево и вправо:
молекул. Наличие явления переноса означает, что молекулы, летящие вправо, и молекулы, летящие влево, имеют разные А. В итоге, мерой М (А) переноса величины А служит разность величин, переносимых влево и вправо:
М (А)=  -
-  . (53)
. (53)
Перед прохождением через площадку S после последнего столкновения проходят путь, равный < λ >, поэтому слева от площадки А есть функция х - < λ >, а справа - функция х + < λ >, где х – координата площадки. С учетом этого (53) можно переписать так:
М (А)=  .
.
Так как  ;
;  , Þ
, Þ
М (А)=  . (54)
. (54)
Это и есть уравнение переноса в общем случае. Теперь перейдем к частным видам этих явлений.
Диффузия в газе. Диффузией называется перенос газа от мест с большей плотностью в места с меньшей плотностью. Пусть плотность зависит только от координаты х. Тогда плотность потока массы j (масса, переносимая в единицу времени через единицу площадки S) равна
 . (55)
. (55)
Это – экспериментальный закон Фика, или уравнение диффузии. Минус показывает, что перенос массы происходит в направлении убывания плотности. В данном случае мерой переноса является величина j, а переносимой величиной – масса молекул, пропорциональная концентрации. Поэтому уравнение переноса (54) можно записать в виде:
 ,
,
где r - плотность. Сравнивая последнее выражение с (55), получим для коэффициента диффузии:
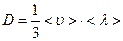 , что после подстановки средних скорости и длины свободного пробега дает:
, что после подстановки средних скорости и длины свободного пробега дает:
 , (56)
, (56)
откуда следует, что коэффициент диффузии прямо пропорционален корню квадратному из температуры и обратно пропорционален концентрации, а, следовательно, и давлению.
Теплопроводность газа возникает вследствие неодинаковой температуры в различных частях объема газа. Быстрые молекулы, попадая из горячих частей объема газа в холодные, отдают последним при столкновениях часть своей энергии. Следовательно, теплопроводность есть перенос внутренней энергии от теплых частей объема газа к холодным. Пусть температура газа зависит только от х. Из опыта установлен закон Фурье (уравнение теплопроводности):
 , (57)
, (57)
где q – плотность потока тепла (количество тепла, переносимое в единицу времени через единицу площади, перпендикулярной ох), κ – коэффициент теплопроводности. Минус указывает, что перенос тепла происходит в направлении уменьшения температуры. При теплопроводности мерой переноса является плотность потока тепла M (A)= q, а переносимой величиной – средняя кинетическая энергия, Þ А=  . Поэтому уравнение переноса (54) можно записать в виде
. Поэтому уравнение переноса (54) можно записать в виде
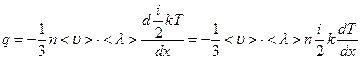 . (58)
. (58)
Учитывая, что  , где CV и сV – молярная и удельная теплоемкости при постоянном объеме соответственно, получим:
, где CV и сV – молярная и удельная теплоемкости при постоянном объеме соответственно, получим:  . Сравнивая с (58), получим формулу для коэффициента теплопроводности
. Сравнивая с (58), получим формулу для коэффициента теплопроводности
 . (59)
. (59)
Подставляя средние  и
и  , получим
, получим
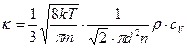 ,
,
откуда видно, что κ ~ 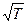 . Коэффициент теплопроводности прямо пропорционален корню из температуры и не зависит от давления газа.
. Коэффициент теплопроводности прямо пропорционален корню из температуры и не зависит от давления газа.
Внутреннее трение в газе связано с возникновением сил трения между слоями газа, движущимися с различными скоростями. Молекулы, попадая из быстрого слоя в медленный, замедляются при столкновениях и, наоборот, при попадании из медленного слоя в быстрый – ускоряются. В результате происходит передача импульса и между слоями возникают силы трения, направленные по касательной к поверхностям, разделяющим слои. Из опыта известно (закон Ньютона), что
 , (60)
, (60)
где τ – напряжение трения (сила трения, отнесенная к площади поверхности соприкосновения слоев), η – коэффициент внутреннего трения (вязкость). Минус возникает из-за того, что силы трения направлены противоположно относительной скорости слоев. При внутреннем трении мерой переноса является напряжение трения: М (А)= τ, а переносимой величиной – модуль импульса (А = mu) упорядоченного движения молекулы в слое газа. Поэтому уравнение переноса (54) можно записать в виде  . Сравнивая с (60) находим выражение для коэффициента вязкости
. Сравнивая с (60) находим выражение для коэффициента вязкости
 . (61)
. (61)
Подставляя в (61) выражения для средних скорости и длины свободного пробега, получим
 ,
,
откуда видно, что η ~ 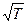 и также не зависит от давления газа.
и также не зависит от давления газа.
Второе начало термодинамики
Не все не противоречащие закону сохранения энергии процессы, могут происходить в реальности. Причины, по которым процесс может идти в одном направлении и не может в другом, объясняет II начало термодинамики, для которого есть несколько формулировок.
1. Клаузиус (1850): невозможен самопроизвольный переход тепла от менее к более нагретому телу, или невозможны процессы, единственным конечным результатом которых был бы переход тепла от менее нагретого тела к более нагретому.
Работа обычного холодильника не противоречит этому утверждению, так как для его работы требуется еще энергия извне (электрическая). Поэтому понижение температуры внутри холодильника и повышение её снаружи не является единственным результатом работы холодильника. Не включенный в сеть холодильник, как известно, не работает.
2. Кельвин (1851): невозможны процессы, единственным конечным результатом которых было бы превращение тепла целиком в работу.
 Пример. Пусть газ изотермически расширился. Внутренняя энергия не изменилась, так как температура осталось прежней, а все полученное тепло перешло в работу. Однако это не единственный результат: в частности, изменился объем.
Пример. Пусть газ изотермически расширился. Внутренняя энергия не изменилась, так как температура осталось прежней, а все полученное тепло перешло в работу. Однако это не единственный результат: в частности, изменился объем. 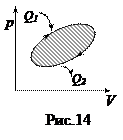 Можно показать, что формулировки 1. и 2. эквивалентны: из первой следует вторая и наоборот. Если бы не второе начало, можно было бы легко решить энергетические проблемы – построить двигатель, который отнимал бы тепло из океанов и целиком превращал его в работу (перпетуум-мобиле II-го рода). Это позволяет перефразировать формулировку Кельвина так: перпетуум-мобиле II -го рода невозможен, или невозможно создать тепловой двигатель с КПД =1.
Можно показать, что формулировки 1. и 2. эквивалентны: из первой следует вторая и наоборот. Если бы не второе начало, можно было бы легко решить энергетические проблемы – построить двигатель, который отнимал бы тепло из океанов и целиком превращал его в работу (перпетуум-мобиле II-го рода). Это позволяет перефразировать формулировку Кельвина так: перпетуум-мобиле II -го рода невозможен, или невозможно создать тепловой двигатель с КПД =1.
Коэффициент полезного действия тепловой машины (КПД). Любой тепловой двигатель работает по замкнутому циклу (рис.14). Если процесс совершается по часовой стрелке, то работа за цикл положительна. Если на каких-то этапах рабочему телу (газу) сообщается тепло Q 1, то, чтобы вернуться в исходное состояние газ должен на других участках цикла отдать холодильнику тепло Q 2. По I началу термодинамики приращение внутренней энергии за цикл = 0, так как система вернулась в исходное состояние, а внутренняя энергия есть функция состояния. Поэтому, работа за цикл А = Q 1- Q 2. КПД теплового двигателя определяется как отношение полезной работы А к полученному теплу Q 1, Þ
h =  . (51)
. (51)
h =1 запрещено II-м началом термодинамики. Опыт также показывает, что h < 1.
Необратимость процессов. Все процессы в макросистемах являются необратимыми. Обратимые процессы – это идеализация, удобная для решения многих важных вопросов. В чем причина необратимости? Необратимость выглядит особенно странно, если учесть, что все законы механики обратимы во времени. И, тем не менее, никто не видел, чтобы, например, разбившаяся ваза самопроизвольно восстановилась из осколков. Загадочны и запреты, устанавливаемые вторым началом термодинамики. Решение этой сложной проблемы пришло с открытием новой термодинамической величины – энтропии - и раскрытием её физического смысла.
Энтропия. По Клаузиусу, энтропия вводится через её элементарное приращение
 . (51)
. (51)
Как известно, 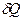 не является дифференциалом функции, но после деления на температуру получается полный дифференциал! В отличие от теплоты, энтропия
не является дифференциалом функции, но после деления на температуру получается полный дифференциал! В отличие от теплоты, энтропия  является такой же функцией состояния как температура, внутренняя энергия или давление. Полученное системой тепло Q зависит от процесса перехода из начального состояния в конечное. Приращение энтропии D S совершенно не зависит от процесса, а только от начального и конечного состояний. В интегральной форме соотношение (51) принимает вид
является такой же функцией состояния как температура, внутренняя энергия или давление. Полученное системой тепло Q зависит от процесса перехода из начального состояния в конечное. Приращение энтропии D S совершенно не зависит от процесса, а только от начального и конечного состояний. В интегральной форме соотношение (51) принимает вид
 , (52)
, (52)
причем совершенно не важно, какой процесс произошел между состояниями 1 и 2, этот процесс может быть даже необратимым, важно лишь, чтобы состояния 1 и 2 были равновесными. Знак равенства в (51) и (52) относится только к квазистатическим (равновесным) процессам. В остальных случаях знак " =" заменяется на знак " > ". Это значит, при неравновесных процессах энтропия получает ещё дополнительное приращение, обусловленное самой необратимостью процесса. Следует добавить, что определение энтропии по формулам (51) и (52) позволяет вычислить только изменение энтропии, но не её абсолютное значение. Это значит, что энтропия определена с точностью до константы. Перечислим некоторые свойства энтропии.
1. Энтропия – функция состояния. Если процесс адиабатический, то Q =0, Þ энтропия остается постоянной.
2. Энтропия аддитивна: энтропия макросистемы равна сумме энтропий её отдельных частей.
3. Несколько позднее мы получим еще одно свойство: энтропия S характеризует степень беспорядка в макросистеме: состояниям с большим беспорядком отвечает большее значение энтропии
Принцип возрастания энтропии замкнутых систем является еще одной формулировкой II-го начала термодинамики: энтропия замкнутой (теплоизолированной) системы не уменьшается – она либо возрастает, либо остается постоянной.
Величина возрастания энтропии в замкнутой макросистеме может служить мерой необратимости процессов. В пределе, когда процессы обратимы, энтропия замкнутой системы остается постоянной. Оказывается, все самопроизвольно и в изолированных условиях протекающие в природе процессы протекают с возрастанием энтропии. Необходимо специальное взаимодействие с окружающей средой, чтобы препятствовать возрастанию энтропии в макросистеме. Ярким примером могут служить все живые существа.
Примеры применения энтропии.
1.Уравнение I-го начала термодинамики с помощью энтропии можно переписать так:
TdS = dU + pdV. (53)
2. Энтропия идеального газа. Разделим (53) на Т подставим для 1 моля газа  :
:
 . Из уравнения состояния для 1 моля газа (pVm=RT) найдем
. Из уравнения состояния для 1 моля газа (pVm=RT) найдем  и подставим во второе слагаемое:
и подставим во второе слагаемое:
 .
.
Дифференциал от логарифма уравнения (pVm=RT) есть  , поэтому
, поэтому
 , Þ
, Þ 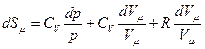 , Þ
, Þ
 , Þ
, Þ
 .
.
Проинтегрируем это уравнение между двумя состояниями 1 и 2:
 . (54)
. (54)
Вследствие аддитивности энтропии, приращение энтропии для ν молей газа будет в ν раз больше.
3. Возрастание энтропии при смешении газов. Пусть в двух половинках теплоизолированного сосуда находятся одинаковые количества двух различных идеальных газов. После удаления перегородки начнется необратимый процесс смешивания газов. Процесс закончится, когда газы будут равномерно перемешаны, т.е. система перейдет в равновесное состояние при той же температуре. Рассмотрим процессы изотермического распространения каждого газа в чужую половинку, как независимые. Изменение энтропии для одного из них равно  , так как внутренняя энергия не изменилась, Þ
, так как внутренняя энергия не изменилась, Þ  , Þ энтропия возрастает, и окончательно
, Þ энтропия возрастает, и окончательно  . Вследствие аддитивности энтропии, приращение энтропии для двух газов в два раза больше:
. Вследствие аддитивности энтропии, приращение энтропии для двух газов в два раза больше: 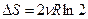 .
.
 Цикл Карно. Тепловой двигатель Карно состоял из нагревателя с температурой
Цикл Карно. Тепловой двигатель Карно состоял из нагревателя с температурой  , холодильника с температурой
, холодильника с температурой  и рабочего тела (идеального газа в цилиндре под поршнем), способного получать тепло и совершать работу. Карно рассмотрел цикл (рис.15) из двух изотерм (ab и cd) и двух адиабат (bc и da). При изотермическом расширении (ab) газ находится в контакте с нагревателем при температуре
и рабочего тела (идеального газа в цилиндре под поршнем), способного получать тепло и совершать работу. Карно рассмотрел цикл (рис.15) из двух изотерм (ab и cd) и двух адиабат (bc и da). При изотермическом расширении (ab) газ находится в контакте с нагревателем при температуре  , и получает тепло Q 1. При изотермическом сжатии (cd) газ находится в контакте с холодильником при температуре
, и получает тепло Q 1. При изотермическом сжатии (cd) газ находится в контакте с холодильником при температуре  , и отдает холодильнику Q 2. В соответствии с (51) КПД теплового двигателя равно
, и отдает холодильнику Q 2. В соответствии с (51) КПД теплового двигателя равно
 . (55)
. (55)
 Цикл Карно является обратимым, т.е. он может быть проведен бесконечно медленно в обратном направлении и при этом газ совершит отрицательную работу, холодильник отдаст газу тепло Q 2, нагреватель получит обратно тепло Q 1. Именно так работает холодильник.
Цикл Карно является обратимым, т.е. он может быть проведен бесконечно медленно в обратном направлении и при этом газ совершит отрицательную работу, холодильник отдаст газу тепло Q 2, нагреватель получит обратно тепло Q 1. Именно так работает холодильник.
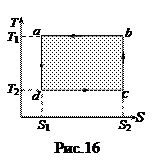
Дальнейшие рассуждения о цикле Карно удобнее проводить в координатах T-S (температура-энтропия), когда цикл изображается прямоугольником (рис.16). В этим случае изотермы изображаются прямыми ab и cd, адиабаты – отрезками bc и da. В соответствии с (52) 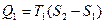 и равно площади под отрезком ab. Отданное холодильнику тепло
и равно площади под отрезком ab. Отданное холодильнику тепло  и равно площади под отрезком cd. Площадь прямоугольника, равная Q 1- Q 2, есть работа А, совершаемая двигателем за цикл. Подставив выражения для Q 1и Q 2 в (55), получим КПД цикла Карно
и равно площади под отрезком cd. Площадь прямоугольника, равная Q 1- Q 2, есть работа А, совершаемая двигателем за цикл. Подставив выражения для Q 1и Q 2 в (55), получим КПД цикла Карно
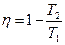 . (56)
. (56)
Полученный вывод составляет содержание знаменитой теоремы Карно: КПД обратимых двигателей, работающих по циклу Карно, зависит только от температур  и
и  - нагревателя и холодильника, но не зависит ни от устройства двигателя, ни от рода рабочего вещества.
- нагревателя и холодильника, но не зависит ни от устройства двигателя, ни от рода рабочего вещества.
 Статистический смысл второго начала термодинамики. Если состояние макросистемы охарактеризовано такими параметрами, как объем, давление, число молей и т.д. говорят, что задано макросостояние. Если состояние макросистемы задано настолько подробно, что указаны положения всех её частиц, то говорят, что задано микросостояние. Любое макросостояние может быть реализовано многими различными способами. Число различных микросостояний, которыми может быть реализовано данное макросостояние называется статистическим весом этого макросостояния.
Статистический смысл второго начала термодинамики. Если состояние макросистемы охарактеризовано такими параметрами, как объем, давление, число молей и т.д. говорят, что задано макросостояние. Если состояние макросистемы задано настолько подробно, что указаны положения всех её частиц, то говорят, что задано микросостояние. Любое макросостояние может быть реализовано многими различными способами. Число различных микросостояний, которыми может быть реализовано данное макросостояние называется статистическим весом этого макросостояния.
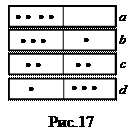
Пример. Пусть в сосуде, разделенном пополам, могут разместиться 4 молекулы. Варианты размещений представлены на рис.17. Пронумеруем молекулы. Каждая из них с равной вероятностью может находиться в каждой половине. Значит, вероятность того, что любая молекула окажется слева равна ½. Пребывание в левой половинке двух молекул – события независимые, поэтому вероятность равна произведению:  ; трех молекул -
; трех молекул - 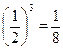 ; четырех молекул -
; четырех молекул -  . Рассуждая аналогично, легко понять, что любое размещение 4-х молекул по двум ячейкам имеет вероятность
. Рассуждая аналогично, легко понять, что любое размещение 4-х молекул по двум ячейкам имеет вероятность  . Каждое размещение соответствует одному микросостоянию, которые все перечислены в таблице 1.
. Каждое размещение соответствует одному микросостоянию, которые все перечислены в таблице 1.
Таблица 1
| Способы реализации микросостояний | Число способов (статистич. вес) Ω | Обычная вероятность Р | |
| В левой половине | В правой половине | ||
| - | 1, 2, 3, 4, | 
| |
| 2, 3, 4 1, 3, 4 1, 2, 4 1, 2, 3 |

| ||
| 1, 2 1, 3 1, 4 2, 3 2, 4 3, 4 | 3, 4 2, 4 2, 3 1, 4 1, 3 1, 2 |

| |
| 1, 2, 3 1, 2, 4 1, 3, 4 2, 3, 4 |

| ||
| 1, 2, 3, 4 | - | 
|
Всего микросостояний 24 =16.
Поскольку для характеристики макросостояния не важно, какие именно из 4-х молекул находятся, например, слева, а важно сколько их, то макросостояние характеризуется числом молекул в половинках слева и справа (аналог концентрации, параметра макросостояния). Всего различных макросостояний пять, и каждому из них соответствует свое число микросостояний (т.е. свой статистический вес Ω). Например, макросостоянию состоящему в том, что в каждой половине сосуда находятся по две молекулы отвечает статистический вес Ω =6, а его вероятность Р =  . Это наиболее вероятное макросостояние. Для N частиц по аналогии с нашим примером вероятность каждого микросостояния будет равна
. Это наиболее вероятное макросостояние. Для N частиц по аналогии с нашим примером вероятность каждого микросостояния будет равна  , а полное число микросостояний 2 N. При N =1020 вероятность каждого микросостояния невообразимо мала:
, а полное число микросостояний 2 N. При N =1020 вероятность каждого микросостояния невообразимо мала:  . Это значит, что макросостояния с небольшим статистическим весом, например все молекулы – в левой части сосуда, становятся практически неосушествимым.
. Это значит, что макросостояния с небольшим статистическим весом, например все молекулы – в левой части сосуда, становятся практически неосушествимым.
Таким образом, мы пришли к важному выводу: предоставленная самой себе макросистема стремится переходить от менее вероятных макросостояний к более вероятным. В этом суть необратимости. Второе начало термодинамики, указывающее на необратимость перехода работы в тепло, обусловлено тем, что обратный переход означал бы переход от более вероятного состояния к менее вероятному.
Энтропия и вероятность. Если макросистема находится в неравновесном состоянии, то она будет переходить в состояние с большей вероятностью – вплоть до равновесия. Вместе с тем, согласно второму началу термодинамики все самопроизвольные процессы в замкнутой макро-системе сопровождаются возрастанием энтропии. Поэтому следует ожидать, что между энтропией макросистемы в каждом состоянии и вероятностью в том же состоянии должна существовать связь (идея Больцмана). Чтобы найти эту связь рассмотрим необратимый процесс расширения идеального газа в пустоту. Пусть сначала газ находился в объеме V 1 теплоизолированного сосуда объемом V o, который разделен перегородками 1 и 2 на три части (рис.18). Допустим, перегородку мгновенно перемещают из положения 1 в положение 2, газ расширяется до объема V 2 и приходит в равновесное состояние. Так как газ при этом работу не совершает (А =0), и (Q= 0), Þ и D U =0: температура газа не меняется. Поскольку энтропия – функция состояния, то ее приращение между состояниями 1 и 2 можно вычислить все равно по какому обратимому процессу, например, изотермическому, хотя во всех остальных отношениях этот процесс протекает по-другому: совершается работа, передается тепло и т.д. В изотермическом процессе
 Q = А =
Q = А =  (см. (22));
(см. (22));
Þ D S =  =
=  =
=  .
.
Поскольку 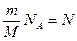 - полному числу молекул, а
- полному числу молекул, а 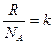 , т.е. постоянной Больцмана, то
, т.е. постоянной Больцмана, то
D S =  . (57)
. (57)
В состояниях 1 и 2 распределение по скоростям должно быть одинаковым, так как масса газа и его температура остались прежними. Но в конечном состоянии молекулы стали располагаться просторнее, значит оно более вероятно. Вероятность нахождения одной молекулы в объеме V 1 равна  , а всех молекул Р 1=
, а всех молекул Р 1=  . Аналогично, вероятность нахождения всех молекул в объеме V 2 равна Р 2=
. Аналогично, вероятность нахождения всех молекул в объеме V 2 равна Р 2=  , а отношение вероятностей
, а отношение вероятностей 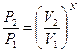 .
.
Подставляя в (57), получим D S = 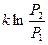 . Поскольку вероятность макросостояния пропорциональ-на его статистическому весу, то
. Поскольку вероятность макросостояния пропорциональ-на его статистическому весу, то  =
= 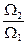 , Þ
, Þ
D S =  . (58)
. (58)
Так мы пришли к знаменитой формуле Больцмана:
S =  . (59)
. (59)
Логарифм в формуле Больцмана - исключительная удача. Ведь логарифм произведения равен сумме логарифмов, что соответствует свойству аддитивности энтропии.
Теперь очевидна и связь энтропии и вероятности (или стат. веса): раз все процессы идут в направлении возрастания Р (и Ω), следовательно, в соответствии с формулой (59) они идут в направлении возрастания энтропии. Принцип возрастания энтропии привел Больцмана к фундаментальному выводу: все замкнутые макросистемы стремятся переходить от состояний менее вероятных к состояниям более вероятным. При этом сама энтропия S характеризует степень беспорядка в макросистеме: состояниям с большим беспорядком отвечает большая вероятность (и Ω) и большее значение энтропии. Именно поэтому и возникает необратимость реальных самопроизвольных процессов. Любой вид энергии в конце концов переходит во внутреннюю энергию, т.е. в равновесное состояние, при котором «хаос» максимален – это состояние с максимальной энтропией.