
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Решение
|
|
При расчетах рН слабых электролитов можно использовать формулу рН = –lg С Н+и учитывать только первую ступень диссоциации:
Н2СО3 ⇄ Н++ НСО3 –,
Константу диссоциации по первой ступени для угольной кислоты находим в приложении: К д1= 4, 45∙ 10-7.
Равновесную концентрацию ионов водорода можно рассчитать двумя способами: непосредственно из выражения для К д и через степень диссоциации α.
1. Если принять концентрацию диссоциированных молекул за С, то равновесные концентрации С Н+и С НСО3 – = С, а равновесная концентрация недиссоциированных молекул С Н2СО3= (0, 002 – С). Подставим эти значения в выражение для К д:
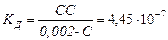 .
.
Решая это уравнения относительно С, получим: С = С Н+= 3∙ 10-5. Откуда рН = -lg С Н+= 4, 52.
2. Поскольку К Д < 10-4, то в данном случае можно рассчитать по упрощенному выражению закона разбавления Оствальда:
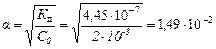 .
.
В соответствии с уравнением диссоциации концентрация ионов С Н+равна концентрации С НСО3 – и концентрации диссоциированных по первой ступени молекул Н2СО3. Тогда, по определению:
α = С / С 0 = С Н+/ С 0 и С Н+= α С 0 = 1, 49∙ 10-2 ∙ 2∙ 10-3 = 2, 98∙ 10–5.
рН = –lg С Н+= 4, 52.
Пример 9. Рассчитайте рН 0, 05 М раствора КОН.