
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ЗАНЯТТЯ №2
|
|
Тема: ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ
Мета заняття: опрацювати основні поняття та закони хімії, встановити межі їх застосування. Навчитись проводити обчислення з використанням понять і основних законів хімії.
ПИТАННЯ ДЛЯ ПІДГОТОВКИ
1. Основні поняття хімії: хімічний елемент, атом, молекуля, проста та складна речовина, відносна атомна маса, відносна молекулярна маса, моль, молярна маса, молярний об’єм, стала Авогадро, еквівалент.
2. Сформулювати закон збереження маси та закон еквівалентів, записати математичні вирази.
3. Закон Авогадро та наслідки з нього.
ТЕОРЕТИЧНІ ВІДОМОСТІ
1. Основні поняття хімії
Хімічний елемент – це певний вид атомів з однаковим позитивним зарядом ядра.
Прості речовини утворені з атомів одного елемента: водень (Н2), азот (N2), сірка (S), мідь (Cu).
Складні речовини утворені з атомів різних елементів: вода (Н2О), кухонна сіль (NaCl).
Молекула – найдрібніша частинка речовини, що зберігає її хімічні властивості і здатна до самостійного існування.
Атом – найдрібніша частинка хімічного елемента, що зберігає його хімічні властивості.
Відносна атомна маса хімічного елемента 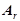 показує, у скільки разів маса атома даного елемента більша за 1/12 маси атома Карбону
показує, у скільки разів маса атома даного елемента більша за 1/12 маси атома Карбону 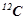 :
:
 .
.
Відносна молекулярна маса 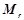 чисельно рівна сумі відносних атомних мас всіх атомів, що входять до складу молекули речовини, наприклад:
чисельно рівна сумі відносних атомних мас всіх атомів, що входять до складу молекули речовини, наприклад:
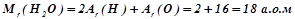 .
.
Моль – це кількість речовини, що містить стільки структурних одиниць (молекул, атомів, іонів), скільки атомів міститься в 12 г ізотопу Карбону 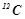 .
.
Стала Авогадро: 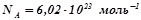 . Це кількість атомів, молекул чи іонів у одному молі речовини. Наприклад,
. Це кількість атомів, молекул чи іонів у одному молі речовини. Наприклад,
1 моль Карбону містить 6, 02·1023 атомів 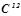 .
.
1 моль води містить 6, 02·1023 молекул 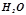 .
.
Молярна маса М (г/моль) – маса одного моля частинок, виражена в грамах.
Молярний об'єм – об'єм 1 моля речовини у газоподібному стані, 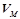 (л/моль). За нормальних умов (н.у.) об’єм 1 моля будь-якого газу становить 22, 4 л (
(л/моль). За нормальних умов (н.у.) об’єм 1 моля будь-якого газу становить 22, 4 л (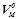 ).
).
Кількість речовини в молях визначається за формулою:
 , або
, або  ,
,
де 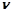 – кількість речовини, моль;
– кількість речовини, моль;
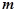 – маса речовини, г;
– маса речовини, г;
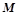 – молярна маса, г/моль;
– молярна маса, г/моль;
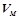 - молярний об’єм газу, л/моль.
- молярний об’єм газу, л/моль.
Еквівалент речовини – це така кількість речовини, яка в хімічних реакціях сполучається з 1 молем атомів Гідрогену, або заміщає таку його кількість. Маса одного моля еквівалентів речовини – молярна маса еквівалента (еквівалентна маса) –  (г/моль екв).
(г/моль екв).
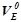 (л/моль екв) – еквівалентний об’єм – це об’єм, який займає за нормальних умов 1 моль еквівалентів газоподібної речовини.
(л/моль екв) – еквівалентний об’єм – це об’єм, який займає за нормальних умов 1 моль еквівалентів газоподібної речовини.
 ;
; 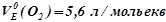 .
.
2. Основні закони хімії
.
Закон збереження маси (Ломоносов 1748 р., Лавуазьє 1789 р.): маса речовин, що вступають у хімічну реакцію, дорівнює масі речовин, що утворились внаслідок реакцій:
 .
.
Закон еквівалентів (Ріхтер, 1803 р.): речовини реагують між собою в еквівалентних кількостях, а маси (об’єми) реагуючих речовин пропорційні їх еквівалентним масам (об’ємам):
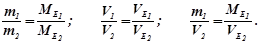
Закон сталості складу (Пруст, 1808р.): всяка речовина має сталий склад незалежно від способу її одержання і місця знаходження в природі.
Закон парціальних тисків (Дальтон): тиск суміші газів, що хімічно не взаємодіють один з одним, дорівнює сумі парціальних тисків газів, що складають суміш.
Закон Авогадро (1811р.): в однакових об'ємах різних газів за однакових умов (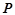 ,
, 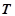 ) міститься однакова кількість молекул.
) міститься однакова кількість молекул.
ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ
Приклад 1. Визначити масу двох моль кальцій нітрату.
Розв’язок.
Обчислюємо молярну масу кальцій нітрату, яка дорівнює сумі атомних мас елементів, що складають молекулу:
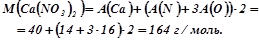
Обчислюємо масу двох моль кальцій нітрату:
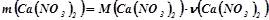 ;
;
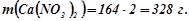
Відповідь: маса двох моль кальцій нітрату 328 г.
Приклад 2. Відносна густина газу за повітрям 1, 52. Визначити молярну масу газу.
Розв’язок.
Відповідно до закону Авогадро при одному і тому ж тиску і температурі маси (m) рівних об’ємів газів відносяться, як їх молярні маси (М):
 ,
,
де 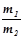 – відносна густина першого газу за другим і позначається літерою D.
– відносна густина першого газу за другим і позначається літерою D.
Отже, за умовою задачі:
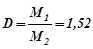 .
.
Середня молярна маса повітря М2= 29 г/моль.
Тоді: M1 = D · M2 = 1, 52 · 29 = 44 г/моль.
Відповідь: молярна маса газу рівна 44 г/моль.
Приклад 3. Визначити молярну масу газу, якщо при нормальних умовах 0, 232 г цього газу займають об’єм 200 мл.
Розв’язок.
За нормальних умов (н.у.) 1 моль будь-якого газу займає об’єм 22, 4 л. Обчисливши масу 22, 4 л. газу, ми визначимо його молярну масу:
0, 232 г газу займає об’єм 0, 2 л
x - - - - - - - - - - - 22, 4 л
 .
.
Відповідь: молярна маса газу 26 г/моль, а його відносна молекулярна маса - 26 а.о.м.
ЗАДАЧІ ТА ВПРАВИ
1. Із 9, 58 г чотиривалентного металу отримали 15, 98 г оксиду. Визначити, який це метал.
2. Визначити масову частку Оксигену в оксидах Карбону (ІІ), (ІV) та у воді.
3. Знайти масу кисню, який при температурі +15 оС і тиску 1 атм. займає об’єм 1 л.
4. Визначити масу 5 моль кристалічної соди  .
.
5. Визначити масу магнію, що міститься у 100 г магній оксиду.
6. Густина деякого газу за повітрям становить 2. Визначити густину цього газу за воднем.
7. При н.у. 250 мл (см3) деякого газу мають масу 0, 1898 г. Визначити молярну масу і абсолютну масу однієї молекули цього газу в грамах.
8. Скільки молекул міститься в 8, 5 г H2S. В якій кількості СО2 міститься стільки ж молекул?
9. При н.у. 500 мл деякого газу важать 0, 3805 г, а маса 250 мл кисню при тих же умовах 0, 3572 г. Розрахувати молярну масу газу двома методами.
10. Який об’єм займуть при н.у. 2, 69 · 1022 молекул газу? Визначити молярну масу цього газу, знаючи, що шуканий об’єм має масу 1, 25 г.
ЛІТЕРАТУРА: [1 – c. 8-23; 2 – c. 11-19; 3 – c. 12-21; 4 – с. 7-17].
ЗАНЯТТЯ № 3
Тема: ВИЗНАЧЕННЯ ЕКВІВАЛЕНТНОЇ МАСИ МЕТАЛУ
Мета заняття: ознайомитись з експериментальним методом визначення еквівалентної маси металу шляхом витіснення водню. Навчитись використовувати для обчислень значення еквівалентних мас та закон еквівалентів.
ПИТАННЯ ДЛЯ ПІДГОТОВКИ
1. Що таке «еквівалент» та «еквівалентна маса»?
2. Сформулювати закон еквівалентів, записати математичний вираз закону.
3. Як обчислюються еквівалент та еквівалентна маса оксидів, основ, кислот, солей?
ТЕОРЕТИЧНІ ВІДОМОСТІ
Еквівалент речовини (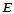 , моль/г·екв) - це така кількість речовини, яка сполучається з 1 молем атомів Гідрогену або заміщає таку його кількість у хімічних реакціях. Маса одного моля еквівалентів речовини називається його еквівалентною масою (
, моль/г·екв) - це така кількість речовини, яка сполучається з 1 молем атомів Гідрогену або заміщає таку його кількість у хімічних реакціях. Маса одного моля еквівалентів речовини називається його еквівалентною масою ( , г/моль.екв).
, г/моль.екв).
Згідно закону еквівалентів маси (об’єми) реагуючих речовин пропорційні їх еквівалентним масам (об’ємам):
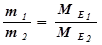 ;
;  .
.
Обчислення еквівалентних мас
1) Проста речовина
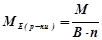 (г/моль екв),
(г/моль екв),
де 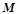 – молярна маса речовини;
– молярна маса речовини;
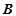 – валентність;
– валентність;
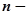 число атомів у молекулі.
число атомів у молекулі.
Наприклад:
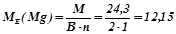 (г/моль екв).
(г/моль екв).
2) Оксид ЕхОу
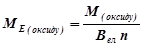 (г/моль екв),
(г/моль екв),
де 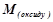 – молярна маса оксиду, г/моль;
– молярна маса оксиду, г/моль;
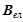 – валентність елемента, який утворює оксид;
– валентність елемента, який утворює оксид;
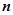 – кількість атомів цього елемента.
– кількість атомів цього елемента.
Наприклад:
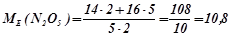 (г/моль екв).
(г/моль екв).
3) Кислота НхЕОу
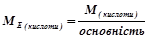 (г/моль екв),
(г/моль екв),
де  – молярна маса кислоти, г/моль;
– молярна маса кислоти, г/моль;
основність – число атомів Гідрогену, що беруть участь у реакції.
Наприклад:
 (г/моль екв).
(г/моль екв).
4) Основа Е(ОН)х
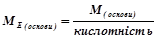 (г/моль екв),
(г/моль екв),
де 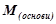 – молярна маса основи, г/моль;
– молярна маса основи, г/моль;
кислотність – число груп ОН–, що беруть участь у реакції.
Наприклад:
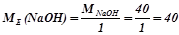 (г/моль екв).
(г/моль екв).
5) Сіль
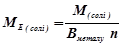 (г/моль екв)
(г/моль екв)
де 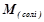 – молярна маса солі, г/моль;
– молярна маса солі, г/моль;
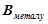 – валентність металу,
– валентність металу,
 – кількість атомів металу.
– кількість атомів металу.
Наприклад:
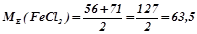 (г/моль екв).
(г/моль екв).
Для обчислення еквівалентних мас складних речовин можна також скористатись такими формулами:
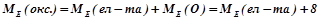 ;
;
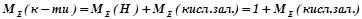 ;
;
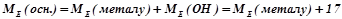 ;
;
 .
.