
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кислоти
|
|
Кислотами називаються сполуки, до складу яких входить Гідроген, здатний заміщуватись на метал. Число атомів Гідрогену, здатних до заміщення, визначає основність кислоти. Наприклад:
– одноосновні кислоти: хлороводнева або хлоридна (соляна) кислота 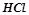 ; нітратна (азотна) кислота
; нітратна (азотна) кислота 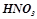 ;
;
– двоосновні кислоти: сульфідна (сірководнева) кислота 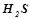 ; сульфатна (сірчана) кислота
; сульфатна (сірчана) кислота  ;
;
– триосновна кислота: ортофосфатна (ортофосфорна) кислота  .
.
За складом кислоти поділяються на оксигеновмісні ( ;
;  ) і безоксигенові (
) і безоксигенові (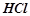 ;
;  ). Деякі найпоширеніші кислоти наведені у таблиці 3.
). Деякі найпоширеніші кислоти наведені у таблиці 3.
Таблиця 3
Склад і назви деяких кислот
| Назва | Формула | Кислотний залишок, його валентність* та назва |
| хлоридна (хлороводнева) | HCl | – Cl (хлорид) |
| сульфідна | H2S | = S (сульфід) |
| метафосфатна | HPO3 | – PO3 (метафосфат) |
| нітратна | HNO3 | – NO3 (нітрат) |
| нітритна | HNO2 | – NO2 (нітрит) |
| карбонатна | H2CO3 | = CO3 (карбонат) |
| сульфітна | H2SO3 | = SO3 (сульфіт) |
| сульфатна | H2SO4 | = SO4 (сульфат) |
| ортофосфатна | H3PO4 | º PO4 (ортофосфат) |
* Кількість рисок відповідає валентності кислотного залишку
Як електроліти кислоти у водних розчинах дисоціюють з утворенням катіона Гідрогену  . За здатністю до дисоціації кислоти поділяються на:
. За здатністю до дисоціації кислоти поділяються на:
– сильні (дисоціює > 50 % молекул) – 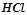 ;
;  ;
;  ;
;
– середні (дисоціює» 30 % молекул) – 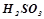 ;
;  ;
;
– слабкі (дисоціює < 3 % молекул) – 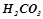 ;
;  .
.
Дисоціація сильної кислоти:
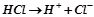 .
.
Дисоціація слабкої кислоти – оборотний процес, що йде до стану рівноваги:
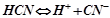 .
.
Для багатоосновних кислот дисоціація – ступінчатий процес.
І ступінь: 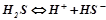 ;
;
ІІ ступінь:  .
.
Хімічні властивості
Взаємодія з основами і основними оксидами:
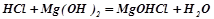 ;
;
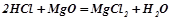 .
.
Взаємодія з амфотерними оксидами і гідроксидами:
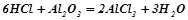 ;
;
 .
.
Взаємодія з солями:
- середніми (сильна кислота витісняє з солі слабку):
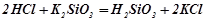 ;
;
- основними (нейтралізація):
 ;
;
- кислими (витіснення сильною кислотою слабкої):
 .
.
Взаємодія з металами (активні метали витісняють з деяких кислот водень):
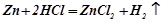 ;
;
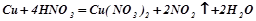 .
.
4. Амфотерні гідроксиди
Амфотерні гідроксиди – це гідроксиди, які залежно від умов реакції можуть проявляти і основні, і кислотні властивості, наприклад:
алюміній гідроксид: 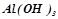 , або
, або 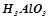 , або
, або 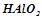 .
.
Вони можуть дисоціювати і як основи, і як кислоти:
 .
.
Хімічні властивості
Взаємодія з кислотами і кислотними оксидами (як основа):
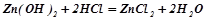 ;
;
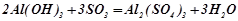 .
.
Взаємодія з основами і основними оксидами (як кислота):
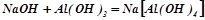 ( у розчині);
( у розчині);
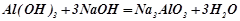 ( при сплавленні);
( при сплавленні);
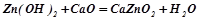 .
.
5. Солі
Солі – це продукти заміщення атомів Гідрогену в кислоті на метал, або гідроксильних груп в основі на кислотний залишок. Солі поділяються на:
- середні (нормальні) – 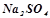 (натрій сульфат);
(натрій сульфат);  (ферум (ІІІ) хлорид);
(ферум (ІІІ) хлорид);
- кислі (гідросолі) – 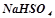 (натрій гідрогенсульфат);
(натрій гідрогенсульфат);  (калій гідрогенкарбонат);
(калій гідрогенкарбонат);
- основні (гідроксосолі) –  (гідроксомагній хлорид);
(гідроксомагній хлорид); 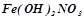 (дигідроксоферум (ІІІ) нітрат);
(дигідроксоферум (ІІІ) нітрат);
- подвійні – 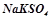 (калій натрій сульфат);
(калій натрій сульфат);
- змішані солі –  (кальцій хлорид гіпохлорит);
(кальцій хлорид гіпохлорит);
- комплексні солі – 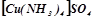 (тетраамінкупрум (ІІ) сульфат).
(тетраамінкупрум (ІІ) сульфат).
Середні солі – це продукт повного заміщення атомів Гідрогену в кислоті або гідроксильних груп в основі:
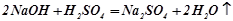 ;
;
натрій сульфат
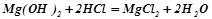 .
.
магній хлорид
Кислі солі – це продукт неповного заміщення атомів Гідрогену в багатоосновній кислоті на метал.
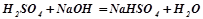 ;
;
натрій
гідроген-
сульфат
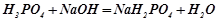 .
.
натрій
дигідроген-
фосфат
Основні солі – це продукт неповного заміщення гідроксильних груп у багатокислотній основі на кислотний залишок:
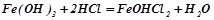 .
.
гідроксоферум
(ІІІ) хлорид
Подвійні солі – містять кілька різних катіонів. Наприклад:  ,
,  . Це продукти заміщення Гідрогену в молекулах кислот на атоми двох металів.
. Це продукти заміщення Гідрогену в молекулах кислот на атоми двох металів.
Змішані солі – це середні солі, в молекулах яких атом металу сполучений з двома різними кислотними залишками, наприклад: 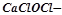 хлорне вапно, сіль хлоридної кислоти (
хлорне вапно, сіль хлоридної кислоти ( ) і хлорнуватистої кислоти
) і хлорнуватистої кислоти 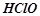 .
.
До складу комплексних солей входить комплексний катіон, наприклад 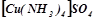 , або комплексний аніон, наприклад
, або комплексний аніон, наприклад  .
.
Хімічні властивості
Взаємодія з лугами:
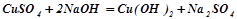 ;
;
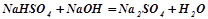 ;
;
 .
.
Взаємодія з кислотами:
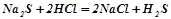 ;
;
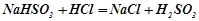 ;
;
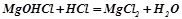 ;
;
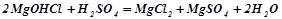 ;
;
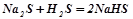 .
.
Взаємодія солей між собою, якщо в результаті реакції утворюється малорозчинна сіль:
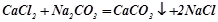 ;
;
Взаємодія з металами: більш активний метал витісняє менш активного з його солі:
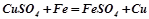 ,
,
але 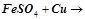 не взаємодіють.
не взаємодіють.