
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Експериментальна частина. Дослід 1. Визначення масової частки, молярної та нормальної концентрації розчинів кислоти та основи
|
|
Дослід 1. Визначення масової частки, молярної та нормальної концентрації розчинів кислоти та основи
1. Налити в циліндр досліджуваний розчин. За допомогою ареометра визначити густину розчину.
2. За густиною досліджуваного розчину знайти масову частку розчиненої речовини, ω, % (табл. 6 або 7).
3. Прийняти масу розчину за 100 г. За означенням маса розчиненої речовини в 100 грамах розчину рівна її масовій частці.
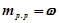 ,
,
де 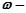 масова частка розчиненої речовини, %;
масова частка розчиненої речовини, %;
4. Визначити об’єм 100 г розчину за формулою:
 ,
,
де  густина розчину, г/см3.
густина розчину, г/см3.
5. Молярну концентрацію обчислити за формулою:
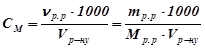 ;
;
де 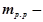 маса розчиненої речовини, г;
маса розчиненої речовини, г;
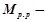 молярна маса розчиненої речовини, г/моль;
молярна маса розчиненої речовини, г/моль;
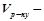 об’єм розчину, мл.
об’єм розчину, мл.
6. Нормальну концентрацію обчислити за формулою:
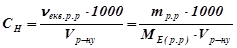 ,
,
де 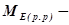 еквівалентна маса розчиненої речовини.
еквівалентна маса розчиненої речовини.
Одержані результати внести до таблиці:
| Розчинена речовина | 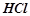 ( (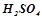 ) )
| 
|
| розчинник | вода | вода |
 , г/см3 , г/см3
| ||
| ω, % | ||
 , моль/л , моль/л
| ||
 , моль∙ екв/л , моль∙ екв/л
|
Таблиця 6
Густина водних розчинів КОН при 15°С
| Концентрація, % | Густина, г/см3 | Концентрація, % | Густина, г/см3 |
| 1, 016 | 1, 196 | ||
| 1, 033 | 1, 217 | ||
| 1, 048 | 1, 240 | ||
| 1, 065 | 1, 263 | ||
| 1, 082 | 1, 286 | ||
| 1, 100 | 1, 310 | ||
| 1, 118 | 1, 334 | ||
| 1, 137 | 1, 358 | ||
| 1, 156 | 1, 384 | ||
| 1, 176 | 1, 411 |
Дослід 2. Визначення реакції середовища розчину за допомогою індикаторів
У дві пробірки налити по 1-2 мл кислоти. Додати в одну пробірку кілька крапель індикатора фенолфталеїну, а в іншу – кілька крапель індикатора метилоранжу. Повторити експеримент з розчином лугу.
Результати досліду оформити у вигляді таблиці, де вказати забарвлення розчинів при дії індикаторів.
| Розчин | Індикатор | Середовище | |
| фенолфталеїн | метиоранж | ||
Дослід 3. Визначення реакції середовища розчину за допомогою універсального індикатора
Налити в пробірку 1-2 мл розчину 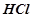 або
або  . Замочити універсальний індикаторний папір досліджуваним розчином. Визначити рН розчину, порівнявши забарвлення паперу з шкалою-еталоном. Повторити експеримент з розчином
. Замочити універсальний індикаторний папір досліджуваним розчином. Визначити рН розчину, порівнявши забарвлення паперу з шкалою-еталоном. Повторити експеримент з розчином  або
або  .
.
Результати записати до таблиці:
| № з/п | Розчин | Забарвлення універсального індикатора | рН розчину | Середовище |
Таблиця 7
Густина водних розчинів деяких кислот за 15°С, г/мл
| % | H2SO4 | HNO3 | HCl | % | H2SO4 | HNO3 |
| 1, 027 | 1, 020 | 1, 018 | 1, 415 | 1, 322 | ||
| 1, 038 | 1, 031 | 1, 028 | 1, 435 | 1, 334 | ||
| 1, 052 | 1, 043 | 1, 038 | 1, 456 | 1, 345 | ||
| 1, 066 | 1, 054 | 1, 047 | 1, 477 | 1, 356 | ||
| 1, 080 | 1, 066 | 1, 057 | 1, 498 | 1, 367 | ||
| 1, 095 | 1, 078 | 1, 068 | 1, 520 | 1, 377 | ||
| 1, 109 | 1, 090 | 1, 078 | 1, 542 | 1, 387 | ||
| 1, 124 | 1, 103 | 1, 088 | 1, 565 | 1, 396 | ||
| 1, 139 | 1, 115 | 1, 098 | 1, 587 | 1, 405 | ||
| 1, 155 | 1, 128 | 1, 108 | 1, 611 | 1, 413 | ||
| 1, 170 | 1, 140 | 1, 119 | 1, 634 | 1, 422 | ||
| 1, 176 | 1, 153 | 1, 129 | 1, 657 | 1, 430 | ||
| 1, 202 | 1, 167 | 1, 139 | 1, 681 | 1, 438 | ||
| 1, 219 | 1, 180 | 1, 149 | 1, 704 | 1, 445 | ||
| 1, 235 | 1, 193 | 1, 159 | 1, 727 | 1, 452 | ||
| 1, 252 | 1, 207 | 1, 169 | 1, 749 | 1, 459 | ||
| 1, 268 | 1, 221 | 1, 179 | 1, 769 | 1, 466 | ||
| 1, 286 | 1, 134 | 1, 189 | 1, 787 | 1, 372 | ||
| 1, 303 | 1, 246 | 1, 198 | 1, 802 | 1, 477 | ||
| 1, 321 | 1, 259 | - | 1, 814 | 1, 483 | ||
| 1, 338 | 1, 272 | - | 1, 824 | 1, 487 | ||
| 1, 357 | 1, 285 | - | 1, 8312 | 1, 491 | ||
| 1, 376 | 1, 298 | - | 1, 8355 | 1, 495 | ||
| 1, 395 | 1, 310 | - | 1, 8395 | 1, 501 | ||
| 1, 8305 | 1, 513 |
ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ
Приклад 1. Обчислення масової частки розчиненої речовини
При 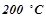 в
в 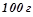 води розчинено
води розчинено 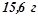 калій нітрату. Масова частка калій нітрату в розчині:
калій нітрату. Масова частка калій нітрату в розчині:
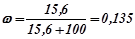 або
або  (мас.).
(мас.).
Приклад 2. Обчислення об’ємної частки розчиненої речовини
 етилового спирту
етилового спирту 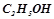 розбавили водою до об’єму
розбавили водою до об’єму 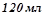 . Об’ємна частка спирту:
. Об’ємна частка спирту:
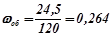 або
або 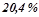 (об.).
(об.).
Приклад 3. Обчислення молярності розчину (молярна концентрація)
Обчислити молярну концентрацію розчину алюміній хлориду з масовою часткою 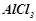
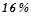 . Густина розчину
. Густина розчину  .
.
Розв’язок: Маса 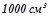 розчину:
розчину:
 .
.
Маса 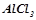 у
у 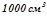 розчину, якщо за умовою у ста грамах розчину є 16 грамів
розчину, якщо за умовою у ста грамах розчину є 16 грамів 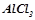 :
:
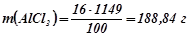 .
.
Кількість речовини 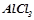 в
в 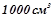 розчину:
розчину:
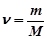 ;
;
 ;
;
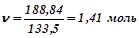
Молярна концентрація:
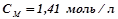 .
.
Приклад 4. Обчислення моляльності розчину (моляльна концентрація)
Яка моляльна концентрація 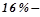 го розчину алюміній хлориду?
го розчину алюміній хлориду?
Розв’язок. За умовою в 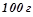 розчину –
розчину – 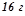
 і
і 
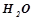 . Маса
. Маса 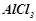 на
на 
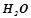 :
:
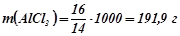 .
.
Кількість моль 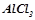 на
на 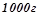
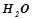 :
:
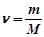 ;
; 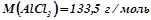 ;
;
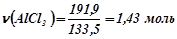 .
.
Моляльність розчину  .
.
Приклад 5. Обчислення молярної (мольної) частки
Знайти мольну частку етилового спирту  у його водному розчині з масовою часткою
у його водному розчині з масовою часткою 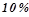
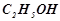 .
.
Розв’язок. За умовою 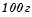 розчину містить
розчину містить 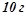
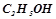 та
та 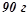
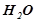 . Кількість речовини (число моль):
. Кількість речовини (число моль): 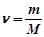 .
.
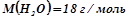 ;
; 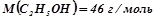 ;
;
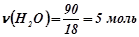 ;
; 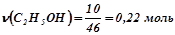 .
.
Мольна частка спирту в розчині
 .
.
ЗАДАЧІ ТА ВПРАВИ
1. В одному літрі (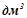 ) розчину знаходиться
) розчину знаходиться  сульфатної кислоти. Яка молярна і еквівалентна концентрація цього розчину? Кислоту рахувати за двохосновну.
сульфатної кислоти. Яка молярна і еквівалентна концентрація цього розчину? Кислоту рахувати за двохосновну.
2. В реакцію з 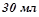 (
(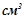 ) сульфатної кислоти вступило
) сульфатної кислоти вступило 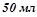 (
(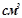 ) розчину лугу з еквівалентною концентрацією
) розчину лугу з еквівалентною концентрацією 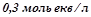 . Скільки грамів сульфатної кислоти витрачено на одержання цього розчину. Використати закон еквівалентів. Кислоту рахувати за двохосновну.
. Скільки грамів сульфатної кислоти витрачено на одержання цього розчину. Використати закон еквівалентів. Кислоту рахувати за двохосновну.
3. Розчин калій нітрату містить 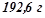
 в одному літрі. Густина розчину
в одному літрі. Густина розчину 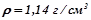 . Розрахувати масову частку солі в розчині і молярну концентрацію розчину.
. Розрахувати масову частку солі в розчині і молярну концентрацію розчину.
4. Обчислити масову частку сульфатної кислоти в її 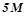 розчині (
розчині ( ).
).
5. Який об’єм води потрібно прилити до  48%-го розчину нітратної кислоти (
48%-го розчину нітратної кислоти (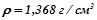 ), щоб одержати 20%-й розчин?
), щоб одержати 20%-й розчин?
6. Якою стане масова відсоткова концентрація 32%-го розчину нітратної кислоти, (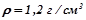 ), коли до
), коли до 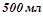 його долити 1 літр води?
його долити 1 літр води?
7. До 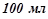 80%-го розчину нітратної кислоти (
80%-го розчину нітратної кислоти (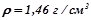 ) долили
) долили 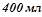 води. Якою стала відсоткова концентрація розчину?
води. Якою стала відсоткова концентрація розчину?
8. Якою стане масова відсоткова концентрація 70%-го розчину сульфатної кислоти (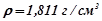 ), якщо до
), якщо до 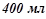 його долити
його долити 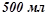 води?
води?
9. Для розчинення деякої маси кальцій карбонату витрачено 
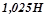 розчину хлоридної кислоти. Обчислити масу взятого кальцій карбонату. Для рішення використати закон еквівалентів.
розчину хлоридної кислоти. Обчислити масу взятого кальцій карбонату. Для рішення використати закон еквівалентів.
10. Обчислити еквівалентну концентрацію (нормальність) 18% розчину натрій гідроксиду (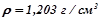 ).
).
11. До  10%-го розчину калій гідроксиду (
10%-го розчину калій гідроксиду (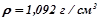 ), долили
), долили  5%-го розчину
5%-го розчину 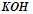 (
( ). Одержаний розчин розбавили водою до об’єму
). Одержаний розчин розбавили водою до об’єму 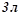 . Яка молярність розчину, що утворився?
. Яка молярність розчину, що утворився?
12. Розчин приготували розчиненням 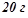 йоду
йоду 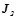 в
в 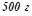 чотирьоххлористого вуглецю
чотирьоххлористого вуглецю  . Обчислити мольну і масову частку йоду в цьому розчині.
. Обчислити мольну і масову частку йоду в цьому розчині.
13. Скільки літрів 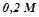 розчину натрій хлориду можна одержати з
розчину натрій хлориду можна одержати з 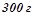
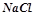 ?
?
14. В  розчину є
розчину є 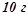 сульфатної кислоти. Обчислити молярну і еквівалентну концентрації цього розчину.
сульфатної кислоти. Обчислити молярну і еквівалентну концентрації цього розчину.
15. Розчин, утворений розчиненням 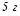 толуолу
толуолу 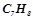 в
в 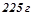 бензолу
бензолу 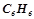 має густину
має густину 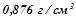 . Обчислити відсоткову і молярну концентрації цього розчину.
. Обчислити відсоткову і молярну концентрації цього розчину.
16. Який об’єм розчину кислоти з еквівалентною концентрацією 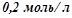 потрібний для нейтралізації
потрібний для нейтралізації  розчину, що містить
розчину, що містить 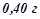 натрій гідроксиду? Для рішення використати закон еквівалентів.
натрій гідроксиду? Для рішення використати закон еквівалентів.
17. Який об’єм 10%-го розчину натрій карбонату (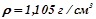 ) потрібно взяти для приготування
) потрібно взяти для приготування 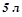 2%-го розчину (
2%-го розчину (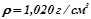 )?
)?
18. Із 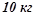 20%-го розчину при охолодженні виділилося
20%-го розчину при охолодженні виділилося  солі. Якою стала відсоткова концентрація охолодженого розчину?
солі. Якою стала відсоткова концентрація охолодженого розчину?
19. Змішали 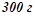 20%-го розчину і
20%-го розчину і 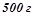 40%-го розчину натрій хлориду. Обчислити масову відсоткову концентрацію одержаного розчину.
40%-го розчину натрій хлориду. Обчислити масову відсоткову концентрацію одержаного розчину.
20. Із 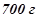 60%-го розчину сульфатної кислоти випарували
60%-го розчину сульфатної кислоти випарували 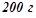 води. Якою стала масова концентрація розчину (у відсотках)?
води. Якою стала масова концентрація розчину (у відсотках)?
ЛІТЕРАТУРА: [1 – c. 186-193; 2 – c. 206-208;
3 – с. 224-231; 4 – с. 153-165]
ЗАНЯТТЯ № 12
Тема: РЕАКЦІЇ У РОЗЧИНАХ ЕЛЕКТРОЛІТІВ
Мета заняття: вивчити процеси електролітичної дисоціації у розчинах та особливості гідролізу солей.
ПИТАННЯ ДЛЯ ПІДГОТОВКИ
1. Електролітична дисоціація. Сильні та слабкі електроліти. Ступінь та константа дисоціації.
2. Іонні рівняння.
3. Водневий показник рН. Індикатори.
4. Гідроліз солей. Вплив процесу гідролізу на величину рН розчинів.
ТЕОРЕТИЧНІ ВІДОМОСТІ
За сучасними уявленнями електролітична дисоціація – це процес розпаду молекул електроліту на іони у розчинах під дією полярних молекул розчинника, або під час розплавлення.
Наприклад: 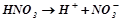 .
.
катіон аніон
Розчини або розплави речовин-електролітів проводять електричний струм. Речовини, розчини чи розплави яких не проводять електричного струму, називаються неелектролітами.
Здатність електроліту дисоціювати на іони кількісно оцінюють величиною ступеня дисоціації. Ступінь дисоціації електроліту (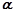 ) – це частка молекул, що розпались на іони. Ступінь дисоціації обчислюється відношенням концентрації дисоційованих молекул (
) – це частка молекул, що розпались на іони. Ступінь дисоціації обчислюється відношенням концентрації дисоційованих молекул (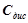 ) до загальної концентрації розчину (
) до загальної концентрації розчину ( ):
):
 .
.
За величиною ступеня дисоціації 0, 001 – 0, 1н розчинів усі електроліти поділяють на сильні і слабкі. До сильних електролітів належать електроліти, які у водних розчинах дисоціюють практично повністю, необоротно. Це майже всі солі, сильні кислоти (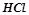 ,
, 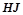 ,
, 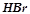 ,
, 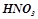 ,
,  ,
, 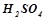 ), сильні основи (основи, утворені лужними та лужноземельними металами –
), сильні основи (основи, утворені лужними та лужноземельними металами – 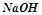 ,
,  ,
, 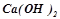 ,
, 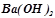 ). У додатку 2 наведено константи дисоціації електролітів. Сильнішим є той електроліт, константа дисоціації якого вища. Слабшими є електроліти з значеннями
). У додатку 2 наведено константи дисоціації електролітів. Сильнішим є той електроліт, константа дисоціації якого вища. Слабшими є електроліти з значеннями 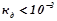 .
.
Слабкі електроліти дисоціюють оборотно, до стану рівноваги. До них належать органічні кислоти ( ), слабкі неорганічні кислоти (
), слабкі неорганічні кислоти (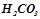 ,
, 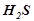 ,
, 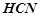 ,
,  ) та слабкі основи (
) та слабкі основи ( ,
, 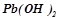 ,
, 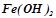 ). Дуже слабким електролітом є вода:
). Дуже слабким електролітом є вода:
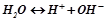 .
.
Для характеристики кислотності чи лужності середовища введено спеціальну величину – водневий показник (рН). Це від’ємний десятковий логарифм молярної концентрації іонів Гідрогену:
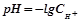
Водневий показник рН визначає характер розчину:
нейтральний розчин: 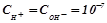 моль/л, рН = 7;
моль/л, рН = 7;
кислий розчин:  моль/л, рН < 7;
моль/л, рН < 7;
лужний розчин: 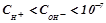 моль/л, рН > 7.
моль/л, рН > 7.
Іонно-молекулярні, або просто іонні рівняння реакцій обміну відображають стан електроліту в розчині. В цих рівняннях сильні розчинні електроліти, які повністю дисоційовані, записують у вигляді іонів, а слабкі електроліти, малорозчинні і газоподібні речовини записують у молекулярній формі. Однакові іони в обох частинах такого рівняння скорочуються.
При складанні іонно-молекулярних рівнянь слід пам’ятати, що сума електричних зарядів в лівій і в правій частині рівняння повинна бути рівною.
Наприклад, молекулярне рівняння:
 ;
;
іонно-молекулярне рівняння:
 ;
;
іонне рівняння:
 .
.
Отже, реакції у водних розчинах відбуваються в тому випадку, коли внаслідок реакції утворюються осад, газ або слабкий електроліт.
У водних розчинах іони солей можуть зв’язуватися з водневими або гідроксильними іонами води, утворюючи слабкий або малорозчинний електроліт. Такий процес називається гідролізом.
Гідролізують лише солі, що утворюються з участю слабких кислот чи основ. Процес гідролізу оборотний і йде до стану рівноваги.
І. Солі, утворені сильною основою і сильною кислотою, не гідролізують. Розчини цих солей нейтральні (рН = 7):
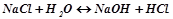 ;
;
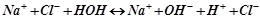 ;
;
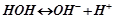 (дисоціація Н2О).
(дисоціація Н2О).
ІІ. Солі, утворені слабкою кислотою і сильною основою: гідролізує аніон, середовище розчину лужне (рН > 7), бо внаслідок гідролізу утворюється іон  (луг):
(луг):
 ;
;
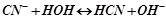 ;
;
 .
.
Якщо гідролізує багатозарядний іон, то гідроліз іде в кілька стадій.
III. Солі, утворені слабкою основою і сильною кислотою: гідролізує катіон, середовище розчину кисле (рН < 7), бо внаслідок гідролізу утворюється катіон  (кислота):
(кислота):
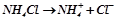 ;
;
 ;
;
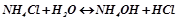 .
.
IV. Солі, утворені слабкою основою і слабкою кислотою: внаслідок гідролізу утворюються дві малодисоційовані або малорозчинні речовини. Солі цього типу гідролізують необоротно і до кінця. Значення рН розчину визначаються константою дисоціації більш слабкого електроліту (кислоти чи основи):
 ;
;
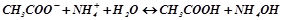 .
.
ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ
Під час розв’язування задач цієї теми слід користуватись додатком 3, де вказана розчинність і додатком 2, де за величиною константи дисоціації можна встановити, сильним чи слабким електролітом є кислота або основа.
Приклад 1. Написати іонно-молекулярні рівняння реакцій взаємодії між водними розчинами наступних речовин:
а) HCl i NaOH; б) Pb(NO3)2 i Na2S; в) NaClO i HNO3 ; г) K2СО3 і H2SO4; д) CH3COOH i NaOH.
Розв’язок. Запишемо рівняння взаємодії вказаних речовин в молекулярному вигляді:
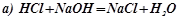 ;
;
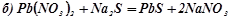 ;
;
 ;
;
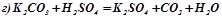 ;
;
 .
.
Записавши сильні розчинні електроліти в іонному вигляді, одержимо повні іонні рівняння:
 ;
;
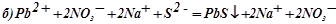 ;
;
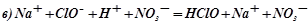 ;
;
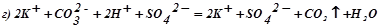 ;
;
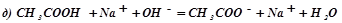 .
.
Виключивши однакові іони із обох частин рівностей, ми одержимо іонно-молекулярні рівняння відповідних реакцій:
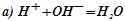 ;
;
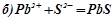 ;
;
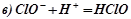 ;
;
 ;
;
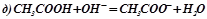 .
.
Взаємодія цих речовин можлива тому, що в результаті відбувається зв’язування іонів з утворенням слабких електролітів (H2O, 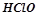 ), осаду (PbS), газу (СО2).
), осаду (PbS), газу (СО2).
В реакції (д) два слабких електроліти, СН3СООН і Н2О, але оскільки реакції ідуть в напрямку більшого зв'язування іонів, а вода – більш слабкий електроліт, ніж оцтова кислота, то рівновага реакції зміщена в напрямку утворення води.
Приклад 2. Скласти іонно-молекулярні і молекулярні рівняння гідролізу солей: а) КCN; б) Na2CO3; в) ZnSO4. Визначити реакцію середовища розчинів цих солей.
Розв’язок.
а) Калій ціанід КCN – сіль слабкої одноосновної кислоти та сильної основи КОН (див. додаток 2). При розчиненні у воді молекули солі повністю дисоціюють на катіони К+ і аніони CN –. Катіони К+ не можуть зв’язати іони ОН – води, оскільки КОН – сильний електроліт.
Аніони CN – зв’язують іони Н+ води, утворюючи молекули слабкого електроліту НСN. Сіль гідролізує, як кажуть, по аніону. Іонно-молекулярне рівняння гідролізу:
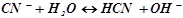 ,
,
або в молекулярній формі
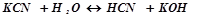 .
.
Внаслідок гідролізу в розчині утворюється надлишок іонів ОН–, тому розчин КСN має лужну реакцію (рН > 7).
б) Натрій карбонат Na2CO3 – сіль слабкої багатоосновної кислоти і сильної основи. В цьому випадку аніони солі СОз2–, зв’язуючи водневі іони води, утворюють аніони кислої солі НСО – 3, а не молекули Н2CO3, поскільки іони НCO3– дисоціюють значно важче, ніж молекули Н2CO3. Тому взвичайних умовах гідроліз відбувається по першій стадії. Сіль гідролізує по аніону.
Іонно-молекулярне рівняння гідролізу:
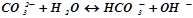 ,
,
або в молекулярній формі
 .
.
В розчині утворюється надлишок іонів ОН–, тому розчин має лужну реакцію (рН > 7).
в) Цинк сульфат ZnSO4 – сіль слабкої основи Zn(OH)2 і сильної кислоти H2SO4. В цьому випадку катіони Zn2+ зв’язують гідроксильні іони води, утворюючи катіони основної солі ZnOH +. Утворення молекул Zn(OH)2 не відбувається, оскільки іони ZnOH+ дисоціюють значно важче, ніж молекули Zn(OH)2. У звичайних умовах гідроліз іде по першій стадії. Сіль гідролізує по катіону. Іонно-молекулярне рівняння гідролізу:
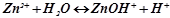
або в молекулярній формі:
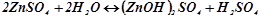 .
.
У розчині утворюється надлишок іонів гідрогену, тому розчин має кислу реакцію (рН < 7).
ЗАДАЧІ ТА ВПРАВИ
1. Написати рівняння електролітичної дисоціації кислоти, основи, солі.
2. Написати рівняння дисоціації на іони сполук-електролітів:  ,
, 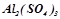 ,
,  , враховуючи можливість ступінчатої дисоціації. Розділити електроліти на сильні, слабкі та середньої сили.
, враховуючи можливість ступінчатої дисоціації. Розділити електроліти на сильні, слабкі та середньої сили.
3. До кожної з речовин: 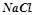 ,
, 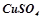 ,
,  ,
, 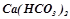 прибавили розчин натрій гідроксиду. В яких випадках відбулись реакції? Виразити їх молекулярними та іонними рівняннями.
прибавили розчин натрій гідроксиду. В яких випадках відбулись реакції? Виразити їх молекулярними та іонними рівняннями.
4. Чому розчин алюміній хлориду має кислу реакцію, розчин калій ціаніду – лужну, а розчин натрій йодиду– нейтральну? Виразити молекулярними і іонно-молекулярними рівняннями реакцій процеси гідролізу.
5. Написати в молекулярному та іонному вигляді рівняння реакцій гідролізу солей: 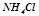 ,
, 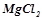 ,
,  ,
, 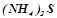 .
.
Яке значення рН мають розчини цих солей?
6. Які з солей  ,
,  ,
,  ,
, 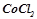 гідролізують? Чому? Скласти молекулярні та іонно-молекулярні рівняння гідролізу цих солей і вказати реакцію розчину кожної солі.
гідролізують? Чому? Скласти молекулярні та іонно-молекулярні рівняння гідролізу цих солей і вказати реакцію розчину кожної солі.
7. Чому розчин нікель сульфату має кислу реакцію, розчин натрій нітриту – лужну, а розчин кальцій хлориду – нейтральну? Скласти молекулярні та іонно-молекулярні рівняння реакцій гідролізу тих з названих солей, які гідролізують.
8. Скласти молекулярні і іонно-молекулярні рівняння таких процесів: а) розчинення купрум (ІІ) гідроксиду в нітратній кислоті; б) взаємодія розчину нікель сульфату з розчином натрій гідроксиду; в) взаємодія розчину натрій сульфіду з розчином купрум (ІІ) хлориду.
9. Скласти молекулярні та іонно-молекулярні рівняння таких реакцій: а) нейтралізація слабкої оцтової кислоти лугом; б) дія сірководню на розчин нікель хлориду; в) взаємодія розчинів барій хлориду і аргентум нітрату.
10. Які з солей 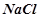 ,
,  ,
, 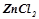 ,
, 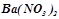 гідролізують? Чому? Скласти молекулярні й іонно-молекулярні рівняння гідролізу. Вказати реакцію розчинів кожної з цих солей.
гідролізують? Чому? Скласти молекулярні й іонно-молекулярні рівняння гідролізу. Вказати реакцію розчинів кожної з цих солей.
ЛІТЕРАТУРА: [1 – с. 207-230; 2 – с. 215-229;
3 – с. 224-254; 4. – с.174-202].
ЗАНЯТТЯ № 13
Тема: ВЛАСТИВОСТІ РОЗЧИНІВ. ЗАКОНИ РАУЛЯ
Мета заняття: засвоїти закон, що виражає залежність фізичних властивостей розчинів (температура кипіння, температура замерзання, осмотичний тиск) від концентрації. Навчитись виконувати відповідні розрахунки.
ПИТАННЯ ДЛЯ ПІДГОТОВКИ
1. Залежність зміни тиску насиченої пари розчинника над розчином від концентрації (І закон Рауля).
2. ІІ закон Рауля: підвищення температури кипіння та пониження температури кристалізації розчину в порівнянні з чистим розчинником. Фізичний зміст ебуліоскопічної та кріоскопічної сталих.
3. Практичне застосування законів Рауля.
4. Осмос. Закон Вант-Гоффа для осмотичного тиску.
5. Відхилення законів Рауля і Вант-Гоффа для розчинів електролітів. Ізотонічний коефіцієнт.
ТЕОРЕТИЧНІ ВІДОМОСТІ
Вивчення властивостей розбавлених розчинів неелектролітів показало, що їхні властивості змінюються пропорційно концентрації розчинів.
Властивості розчинів, які залежать лише від числа частинок в розчині і не залежать від природи розчиненої речовини, називаються коллігативними. Це зміна осмотичного тиску, температури кипіння, температури кристалізації розчину в порівнянні з чистим розчинником, які зумовлені зниженням тиску насиченої пари над розчином.
1. Розчини неелектролітів.
Число частинок у розчинах неелектролітів визначається лише концентрацією розчинів.
І закон Рауля: відносне зниження тиску насиченої пари розчинника над розчином пропорційне мольній частці розчиненої речовини:
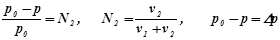 ,
,
де 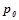 – тиск насиченої пари розчинника над чистим розчинником;
– тиск насиченої пари розчинника над чистим розчинником;
 – тиск насиченої пари розчинника над розчином;
– тиск насиченої пари розчинника над розчином;
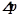 – зниження тиску пари;
– зниження тиску пари;
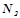 – мольна частка розчиненої речовини;
– мольна частка розчиненої речовини;
 – кількість речовини розчинника, моль;
– кількість речовини розчинника, моль;
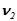 – кількість розчиненої речовини, моль.
– кількість розчиненої речовини, моль.
ІІ закон Рауля: підвищення температури кипіння (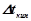 ) і зниження температури кристалізації (
) і зниження температури кристалізації (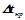 ) розчину прямо пропорційне моляльній концентрації розчиненої речовини:
) розчину прямо пропорційне моляльній концентрації розчиненої речовини:
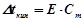 ,
, 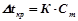 ,
,
де 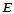 – ебуліоскопічна константа розчинника;
– ебуліоскопічна константа розчинника;
 – кріоскопічна константа розчинника;
– кріоскопічна константа розчинника;
 – моляльна концентрація розчину.
– моляльна концентрація розчину.
Значення кріоскопічної та ебуліоскопічної сталої для деяких розчинників наведені в таблиці 8.
Таблиця 8
Кріоскопічні і ебуліоскопічні константи деяких розчинників
| Розчинник | Кріоскопічна константа К, град·кг/моль | Ебуліоскопічна константа Е, град·кг/моль |
| Вода | 1, 86 | 0, 52 |
| Бензол | 5, 14 | 2.57 |
| Хлороформ | 4, 90 | 3, 88 |
| Оцтова кислота | 3, 90 | 3, 10 |
| Етанол | - | 1, 20 |
| Диетиловий ефір | 1, 73 | 2, 02 |
Осмотичний тиск розчину пропорційний його молярній концентрації і температурі (закон Вант-Гоффа):
 ,
,
де 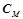 – молярна концентрація;
– молярна концентрація;
 – універсальна газова стала;
– універсальна газова стала;
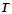 – температура, К.
– температура, К.
2. Розчини електролітів
Колігативні властивості розчинів неелектролітів (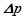 ,
, 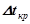 ,
, 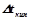 ,
, 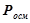 ) лінійно залежать від числа частинок розчиненої речовини. У розчинах електролітів – кислот, основ або солей спостерігаються істотні відхилення від законів Рауля та Вант-Гоффа.
) лінійно залежать від числа частинок розчиненої речовини. У розчинах електролітів – кислот, основ або солей спостерігаються істотні відхилення від законів Рауля та Вант-Гоффа.
На відміну від розчинів неелектролітів, у розчинах електролітів число частинок не відповідає числу молекул, воно збільшується за рахунок електролітичної дисоціації розчиненої речовини. Тому експериментальні значення величин 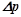 ,
, 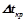 ,
, 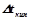 ,
, 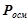 для розчинів кислот, основ і солей більші за теоретично обчислені за відповідними законами Рауля і Вант-Гоффа. Для оцінки міри відхилення Вант-Гофф запропонував ввести так званий ізотонічний коефіцієнт, який є відношенням відповідних експериментальних значень величин
для розчинів кислот, основ і солей більші за теоретично обчислені за відповідними законами Рауля і Вант-Гоффа. Для оцінки міри відхилення Вант-Гофф запропонував ввести так званий ізотонічний коефіцієнт, який є відношенням відповідних експериментальних значень величин 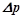 ,
, 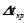 ,
,  ,
, 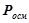 до теоретично обчислених:
до теоретично обчислених:
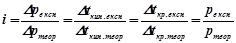 .
.
Ізотонічний коефіцієнт і пов’язаний із ступенем дисоціації електроліту 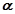 співвідношенням:
співвідношенням:
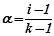 ,
,
де  – ізотонічний коефіцієнт;
– ізотонічний коефіцієнт;
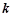 – число іонів, на які дисоціює молекула електроліту, наприклад, для
– число іонів, на які дисоціює молекула електроліту, наприклад, для 
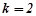 , для
, для 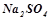
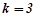 .
.
Для розчинів електролітів закони Рауля і Вант-Гоффа мають вигляд:
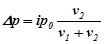 .
.
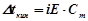 ;
;
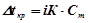 ;
;
 .
.
ПРИКЛАДИ РОЗВ’ЯЗУВАННЯ ЗАДАЧ
Приклад 1. Обчислити температуру кристалізації та кипіння 2% водного розчину глюкози 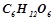 .
.
Розв’язок. За законом Рауля пониження температури кристалізації і підвищення температури кипіння розчину визначаються рівняннями:
 ; (1)
; (1)
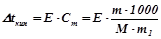 , (2)
, (2)
де  – кріоскопічна константа (
– кріоскопічна константа (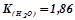 );
);
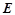 – ебуліоскопічна константа (
– ебуліоскопічна константа (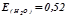 );
);
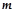 i
i  – маса розчинної речовини, (г) і її молярна маса, (г/моль);
– маса розчинної речовини, (г) і її молярна маса, (г/моль);
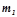 – маса розчинника, (г).
– маса розчинника, (г).
Пониження температури кристалізації 2%-го розчину глюкози знаходимо з формули (1);
 ;
;
 .
.
Вода кристалізується при 0 0С, отже, температура кристалізації розчину
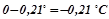 .
.
За формулою (2) знаходимо підвищення температури кипіння 2%-го розчину глюкози:
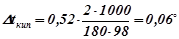 .
.
Вода кипить при 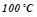 , отже, температура кипіння цього розчину:
, отже, температура кипіння цього розчину:
 .
.
Приклад 2. Розчин, що містить 8 г неелектроліту в 100 г диетилового ефіру, кипить при 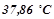 , тоді як чистий ефір кипить при
, тоді як чистий ефір кипить при 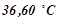 . Обчислити молярну масу розчиненої речовини.
. Обчислити молярну масу розчиненої речовини.
Розв’язок. З умови задачі знаходимо:
 .
.
За формулою 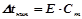 знаходимо моляльність розчину:
знаходимо моляльність розчину:
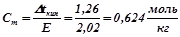 ;
;
 ,
,
де 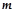 i
i 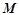 – маса розчиної речовини і її молярна маса;
– маса розчиної речовини і її молярна маса;
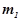 – маса розчинника.
– маса розчинника.
 .
.
Молярна маса розчиненої речовини 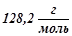 .
.
Приклад 3. Розчин, що містить 0, 85 г цинк хлориду в 125 г води кристалізується при 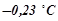 . Визначити ступінь дисоціації
. Визначити ступінь дисоціації 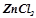 .
.
Розв’язок. Ступінь дисоціації визначаємо з формули:
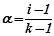 ,
,
де  – ізотонічний коефіцієнт;
– ізотонічний коефіцієнт;
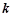 – кількість іонів, на які дисоціює
– кількість іонів, на які дисоціює 
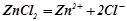
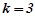 ;
;
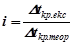 ,
,
де 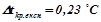 (за умовою задачі);
(за умовою задачі);
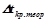 – пониження температури кристалізації без врахування дисоціації електроліту.
– пониження температури кристалізації без врахування дисоціації електроліту.
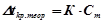 ;
;
 ;
;
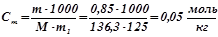 ;
;
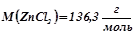 ;
;
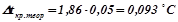 .
.
Порівнюючи знайдене значення з експериментально визначеним пониженням температури кристалізації, знаходимо ізотонічний коефіцієнт  :
:
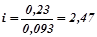 .
.
Ступінь дисоціації солі:
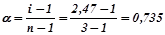 або
або 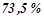 .
.
ЗАДАЧІ ТА ВПРАВИ
1. При розчиненні 8 г нафталіну в 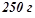 бензолу
бензолу 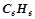 температура кипіння останнього підвищилась на
температура кипіння останнього підвищилась на  . Визначити молярну масу розчинної речовини, якщо ебуліоскопічна константа бензолу дорівнює
. Визначити молярну масу розчинної речовини, якщо ебуліоскопічна константа бензолу дорівнює 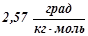 .
.
2. У 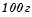 води розчинили
води розчинили 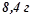 сечовини
сечовини 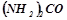 . Визначити:
. Визначити:
а) при якій температурі закипить розчин, що утворився;
б) при якій температурі замерзне цей розчин?
3. При розчиненні в 400 мл води 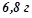 неелектроліту утворився розчин з температурою замерзання
неелектроліту утворився розчин з температурою замерзання  . Визначити молярну масу розчиненої речовини.
. Визначити молярну масу розчиненої речовини.
4. Розчин, який містить 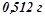 неелектроліту в
неелектроліту в  бензолу, кристалізується при
бензолу, кристалізується при 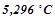 . Температура кристалізації бензолу
. Температура кристалізації бензолу 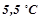 . Обчислити молярну масу розчиненої речовини.
. Обчислити молярну масу розчиненої речовини.
5. Обчислити відсоткову концентрацію водного розчину цукру 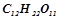 , якщо відомо, що температура кристалізації розчину дорівнює
, якщо відомо, що температура кристалізації розчину дорівнює  . Кріоскопічна константа води
. Кріоскопічна константа води 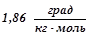 .
.
6. Обчислити відсоткову концентрацію водного розчину метанолу 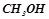 , якщо відомо, що температура кристалізації розчину
, якщо відомо, що температура кристалізації розчину 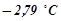 .
.
7. Скільки грамів аніліну  потрібно розчинити з
потрібно розчинити з  етилового ефіру, щоб температура кипіння розчину була вища від температури кипіння етилового ефіру на
етилового ефіру, щоб температура кипіння розчину була вища від температури кипіння етилового ефіру на 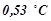 ?
?
8. Чи при однаковій температурі замерзатимуть розчини, що містять 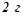 формаліну
формаліну 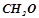 в
в  води і
води і 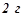 глюкози
глюкози 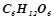 в
в 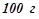 води? Відповідь обґрунтувати розрахунками температур замерзання.
води? Відповідь обґрунтувати розрахунками температур замерзання.
9. Обчислити кріоскопічну константу оцтової кислоти, якщо відомо, що розчин 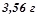 антрацену
антрацену 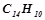 в
в 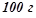 оцтової кислоти кристалізується при
оцтової кислоти кристалізується при  . Температура кристалізації оцтової кислоти
. Температура кристалізації оцтової кислоти 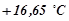 .
.
10. Рівні вагові кількості камфори 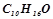 і нафталіну
і нафталіну 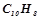 розчинені в однакових кількостях бензолу. Який із розчинів кипить при вищій температурі?
розчинені в однакових кількостях бензолу. Який із розчинів кипить при вищій температурі?
11. Температура кристалізації розчину, який містить 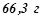 деякого неелектроліту в
деякого неелектроліту в 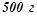 води, становить
води, становить 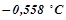 . Обчислити молярну масу розчиненої речовини. Кріоскопічна константа води
. Обчислити молярну масу розчиненої речовини. Кріоскопічна константа води 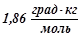 .
.
12. Скільки грамів сечовини 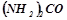 потрібно розчинити в
потрібно розчинити в  води, щоб температура кристалізації понизилась на
води, щоб температура кристалізації понизилась на 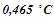 ? Кріоскопічна константа води
? Кріоскопічна константа води  .
.
13. Обчислити температуру кристалізації 2%-го розчину етилового спирту 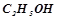 , якщо кріоскопічна константа води
, якщо кріоскопічна константа води 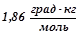 .
.
14. Обчислити процентну концентрацію водного розчину глюкози 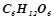 , якщо відомо, що цей розчин кипить при
, якщо відомо, що цей розчин кипить при 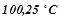 . Ебуліоскопічна константа води
. Ебуліоскопічна константа води 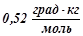 .
.
15. Скільки грамів глюкози 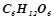 треба розчинити в
треба розчинити в 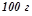 води:
води:
а) щоб знизити її температуру замерзання на 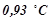 ;
;
б) щоб підвищити температуру кипіння на 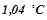 ?
?
16. У радіатор автомобіля налили 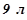 води і додали
води і додали 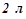 метилового спирту
метилового спирту 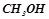 (
(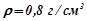 ). При якій найнижчій температурі можна після цього залишати автомобіль на відкритому повітрі, не боячись, що вода в радіаторі замерзне?
). При якій найнижчій температурі можна після цього залишати автомобіль на відкритому повітрі, не боячись, що вода в радіаторі замерзне?
17. Визначити осмотичний тиск 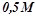 розчину глюкози
розчину глюкози 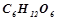 при
при 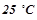 .
.
18. До 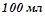
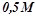 водного розчину сахарози
водного розчину сахарози 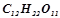 добавили
добавили 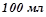 води. Визначити осмотичний тиск одержаного розчину при
води. Визначити осмотичний тиск одержаного розчину при 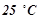 .
.
19. Розчин, що містить 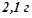
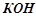 в
в 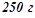 води, кристалізується при
води, кристалізується при 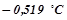 . Обчислити ізотонічний коефіцієнт цього розчину.
. Обчислити ізотонічний коефіцієнт цього розчину.
20. Розчин, що містить 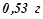 натрій карбонату в
натрій карбонату в