
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Експериментальна частина. Дослід 1. Залежність швидкості реакції від концентрації реагуючих речовин
|
|
Дослід 1. Залежність швидкості реакції від концентрації реагуючих речовин
а) Налити в пробірку 1-2 мл розчину натрій тіосульфату і додати стільки ж сульфатної кислоти. Спостерігати помутніння розчину внаслідок виділення вільної сірки, яка утворюється при взаємодії натрій тіосульфату з сульфатною кислотою:
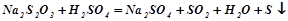 .
.
Час, який проходить від початку реакції до явного помутніння розчину, визначає швидкість реакції.
б) В три колби налити 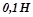 розчин натрій тіосульфату
розчин натрій тіосульфату 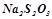 : у першу – 5 мл, у другу – 10 мл, у третю – 15 мл. До вмісту першої колби добавити 10 мл води, до другої – 5 мл. В кожну колбу по черзі доливати по 5 мл 2% розчину сульфатної кислоти, визначаючи час від моменту доливання кислоти до помутніння розчину в колбі.
: у першу – 5 мл, у другу – 10 мл, у третю – 15 мл. До вмісту першої колби добавити 10 мл води, до другої – 5 мл. В кожну колбу по черзі доливати по 5 мл 2% розчину сульфатної кислоти, визначаючи час від моменту доливання кислоти до помутніння розчину в колбі.
Результати записати в таблицю, обчисливши швидкість реакції.
Результати досліду
| Параметри досліду | Номер колби | ||
| Об’єм Na 2 S 2 O, мл | |||
| Об’єм H 2 O, мл | – | ||
| Умовна концентрація тіосульфату | 1 с | 2 с | 3 с |
| Об’єм H 2 SO 4, мл | |||
| Час до появи каламуті t, с | |||
| Швидкість реакції, V=1/t |
За результатами досліду побудувати графік, відкладаючи на осі абсцис значення умовної концентрації натрій тіосульфату 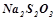 , а на осі ординат – швидкість реакції
, а на осі ординат – швидкість реакції  .
.
Зробити висновок про характер залежності швидкості хімічної реакції від концентрації реагуючих речовин. Чи узгоджуються одержані результати з законом діючих мас?
Дослід 2. Залежність швидкості реакції від температури
Налити в три пробірки по 5 мл розчину 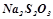 , в інші три пробірки – по 5 мл розчину
, в інші три пробірки – по 5 мл розчину 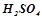 . Розділити пробірки на три пари: по 1 пробірці з розчинами
. Розділити пробірки на три пари: по 1 пробірці з розчинами 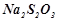 і
і 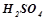 в кожній парі.
в кожній парі.
Відмітити температуру повітря в лабораторії, злити разом розчини першої пари пробірок і визначити час від моменту зливання до помутніння розчину.
Дві другі пробірки помістити на 5 хвилин у хімічну склянку з водою, нагрітою на 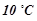 вище від кімнатної температури. Температуру міряти термометром, опущеним у хімічну склянку з водою. Злити вміст пробірок, відмітити час з моменту зливання розчинів до помутніння.
вище від кімнатної температури. Температуру міряти термометром, опущеним у хімічну склянку з водою. Злити вміст пробірок, відмітити час з моменту зливання розчинів до помутніння.
Повторити дослід з останніми двома пробірками, нагрівши їх до температури на 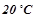 вище кімнатної.
вище кімнатної.
Результати досліду занести в таблицю, обчисливши швидкість реакції.
Результати досліду
| Номер колби | |||
Об’єм 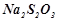 , мл , мл
| |||
Об’єм 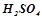 , мл , мл
| |||
| Температура, t 0 C | |||
| Час до появи каламуті t, с | |||
Швидкість реакції, 
|
Побудувати графік залежності швидкості реакції від температури досліду, відклавши на осі абсцис значення температури експерименту, а на осі ординат – значення швидкості реакції.
Зробити висновок про характер залежності швидкості реакцій від температури, обчисливши температурний коефіцієнт реакції. Чи відповідає знайдена залежність правилу Вант Гоффа?
Дослід 3. Вплив концентрації реагуючих речовин на зміщення хімічної рівноваги
Налити в пробірку близько 1/3 об’єму розведеного розчину ферум (ІІІ)хлориду і долити еквівалентну кількість розведеного розчину калій роданіду. Спостерігати забарвлення розчину в інтенсивно червоний колір, який зумовлюється утворенням ферум (ІІІ)роданіду Fe (SCN)3 .
Записати рівняння оборотної реакції в молекулярному вигляді і вираз константи її рівноваги.
Одержаний розчин розлити порівну в чотири пробірки. В першу долити краплями концентрованого розчину калій роданіду, в другу - концентрованого розчину ферум (ІІІ) хлориду, а до третьої додати декілька кристаликів калій хлориду. Четверта пробірка – для порівняння (еталон).
Порівняти інтенсивність забарвлення розчину у трьох пробірках з інтенсивністю забарвлення еталону і описати спостереження.
На підставі зміни інтенсивності забарвлення розчину вказати, в якому напрямі зміщується рівновага даної системи за принципом Лешательє:
а) при додаванні ферум (ІІІ) хлориду;
б) при додаванні калій роданіду;
в) при додаванні калій хлориду.
ЗАДАЧІ ТА ВПРАВИ
1. Записати математичний вираз швидкості таких хімічних реакцій:
 ;
;
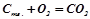 ;
;
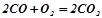 .
.
2. Записати вирази для швидкості таких реакцій:
а) 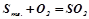 ;
;
б) 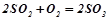 .
.
Об’єм кожної із систем зменшили в 4 рази. Як зміняться концентрації реагуючих речовин? Записати вирази для швидкості реакцій після зміни об’єму. Як змінилися швидкості кожної з цих реакцій?
3. Реакція проходить за таким рівнянням:  . Константа швидкості цієї реакції при деякій температурі рівна
. Константа швидкості цієї реакції при деякій температурі рівна 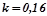 . Початкові концентрації реагуючих речовин:
. Початкові концентрації реагуючих речовин: 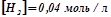 ;
; 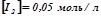 . Обчислити початкову швидкість реакції і її швидкість, коли концентрація гідрогену зменшилась до
. Обчислити початкову швидкість реакції і її швидкість, коли концентрація гідрогену зменшилась до 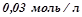 .
.
4. Як зміниться швидкість реакції в газовій фазі при підвищенні температури на 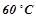 , якщо температурний коефіцієнт швидкості даної реакції дорівнює
, якщо температурний коефіцієнт швидкості даної реакції дорівнює 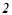 ?
?
5. Записати вираз константи рівноваги для реакції:
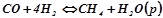 .
.
Як змінити тиск, щоб збільшити вихід метану?
6. Константа швидкості реакції  рівна
рівна 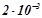 :
:
а) яка швидкість 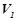 даної реакції в початковий момент, коли концентрація речовини
даної реакції в початковий момент, коли концентрація речовини  рівна
рівна  , речовини
, речовини 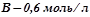 ;
;
б) якою буде швидкість V 2 цієї реакції через деякий час, коли утворилося 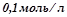 речовини
речовини 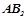 ?
?
7. В якому напрямі зміститься рівновага таких оборотних реакцій:
а)  ;
;
б)  ;
;
в) 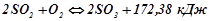
при пониженні температури; при пониженні тиску? Записати вирази константи рівноваги для даних реакцій.
ЛІТЕРАТУРА: [1 – c. 153-176; 2 – c. 159-175;
3 – с. 139-163; 4 – с. 164-190].
ЗАНЯТТЯ № 11
Тема: РОЗЧИНИ. СПОСОБИ ВИРАЖЕННЯ КОНЦЕНТРАЦІЇ РОЗЧИНІВ.
Мета заняття: ознайомитись з процесом утворення розчинів та основними способами вираження їх кількісного складу. Навчитись обчислювати концентрації розчинів та вести перерахунки з одного способу вираження концентрації в інший.
ПИТАННЯ ДЛЯ ПІДГОТОВКИ
1. Що таке розчини? Чим відрізняється розчин від суміші?
2. Що означають поняття «концентрація розчину», «розчинність», «насичений розчин»?
3. Основні способи вираження концентрації розчинів.
4. Основні положення гідратної теорії розчинів.
ТЕОРЕТИЧНІ ВІДОМОСТІ
Істинними розчинами називають стійкі рідкі або тверді гомогенні дисперсні системи, склад яких може змінюватися в досить широких межах. Розчинення – самовільний процес розподілу молекул чи іонів однієї речовини в іншій в результаті дифузії.
Складовими частинами (компонентами) розчинну є розчинник і розчинена речовина. Кількісний склад розчинів визначається концентрацією, тобто відносним вмістом компонентів.
Концентрацією розчину називається кількість розчиненої речовини, що міститься у певній кількості розчинника або розчину. При обчисленні концентрації розчинів використовують позначення:
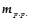 – маса розчиненої речовини, г;
– маса розчиненої речовини, г;
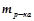 – маса розчинника, г;
– маса розчинника, г;
 – масса розчину, г;
– масса розчину, г;
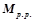 – молярна маса розчиненої речовини, г/моль;
– молярна маса розчиненої речовини, г/моль;
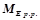 – еквівалентна маса розчиненої речовини, г/моль екв;
– еквівалентна маса розчиненої речовини, г/моль екв;
 – кількість розчиненої речовини, моль;
– кількість розчиненої речовини, моль;
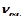 – кількість еквівалентів розчиненої речовини, моль екв;
– кількість еквівалентів розчиненої речовини, моль екв;
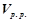 – об’єм розчиненої речовини, л або мл;
– об’єм розчиненої речовини, л або мл;
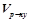 – об’єм розчину, л або мл.
– об’єм розчину, л або мл.
Однією з характеристик розчину є густина ( , г/см3 або кг/м3). Це маса одиниці об’єму розчину. Густину враховують при обчисленні концентрації розчинів:
, г/см3 або кг/м3). Це маса одиниці об’єму розчину. Густину враховують при обчисленні концентрації розчинів:
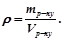
Способи вираження концентрації розчинів
1) Масова частка (відсоток, процент) розчиненої речовини (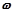 ) – це відношення маси розчиненої речовини до маси розчину, прийнятої за 1 або за 100:
) – це відношення маси розчиненої речовини до маси розчину, прийнятої за 1 або за 100:
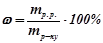 .
.
Відсоток показує, скільки грамів розчиненої речовини міститься у ста грамах розчину.
2) Об’ємна частка розчиненої речовини (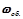 ) – це відношення об’єму розчиненої речовини до об’єму розчину.
) – це відношення об’єму розчиненої речовини до об’єму розчину.
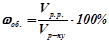 .
.
3) Молярність, молярна концентрація (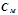 , моль/л) визначає кількість моль розчиненої речовини в
, моль/л) визначає кількість моль розчиненої речовини в 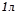 (
( ) розчину:
) розчину:
 ;
;
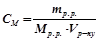 .
.
4) Нормальність, нормальна або еквівалентна концентрація (молярна концентрація еквівалента) (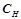 , моль екв/л) визначає кількість моль еквівалентів розчиненої речовини в 1 л (1000 мл) розчину:
, моль екв/л) визначає кількість моль еквівалентів розчиненої речовини в 1 л (1000 мл) розчину:
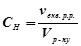 ;
;
 .
.
5) Моляльність, моляльна концентрація ( , моль/кг) визначає кількість моль розчиненої речовини на 1 кг розчинника:
, моль/кг) визначає кількість моль розчиненої речовини на 1 кг розчинника:
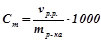 ;
;
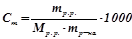 .
.
6) Мольна частка  визначає частку моль одного з компонентів розчину від загального числа моль всіх компонентів, включаючи розчинник:
визначає частку моль одного з компонентів розчину від загального числа моль всіх компонентів, включаючи розчинник:
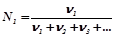 ,
,
де 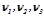 – кількість речовини компонентів 1, 2, 3 і т.д.
– кількість речовини компонентів 1, 2, 3 і т.д.
Знаючи нормальність розчинів, що вступають у реакцію, можна обчислити, які об’єми потрібно змішати, щоб розчинені речовини прореагували без залишку.