
Главная страница Случайная страница
КАТЕГОРИИ:
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Экспериментальная часть.
|
|
Для выполнения работы используется калориметр (рис.1.), прибор, содержащий сосуд, который защищен от потерь тепла и имеющий достаточно чувствительный термометр.
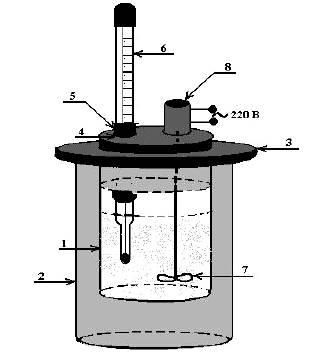
Рис.1. Калориметр
Калориметр, как правило, состоит из следующих частей:
1) калориметрический сосуд
2) изотермическая оболочка
3) крышка
4) отверстие для введения навески
5) пробка
6) термометр Бекмана
7) мешалка
8) отверстие для электромотора мешалки
В фарфоровый стакан (внешний сосуд) помещен внутренний стеклянный сосуд с изолирующими прослойками воздуха между стенками и дном внешнего сосуда. Калориметр снабжен крышкой с отверстиями для термометра, мешалки и шприца с навеской соли. Шприц имеет съемное донышко, вместе с которым соль в нужный момент выдавливается в воду внутреннего сосуда.
Изменение температуры в процессе растворения соли фиксируют термометром Бекмана (точность до 0, 01º С). С его помощью измеряют не абсолютную температуру раствора, а разность температур при растворении. Шкала термометра имеет пять больших единиц, каждая из которых соответствует одному градусу. Если к началу работы ртутный столбик термометра находится за пределами шкалы, термометр следует настроить по указанию преподавателя.
Внутренний сосуд калориметра наполните на ¾ охлажденной дистиллированной водой, добейтесь установления температуры на 2-3 градуса ниже комнатной. Температуру измеряйте основным лабораторным термометром.
Получив нужную температуру в сосуде, отмерьте мерным цилиндром 500 мл этой охлажденной воды, излишек воды слейте в раковину, а отмеренные 500 мл поместите обратно в стеклянный сосуд.
Параллельно взвесьте на весах 5 г навески безводной соли с точностью до 0, 01г и поместите ее в шприц, проследив за тщательным прилеганием съемного донышка шприца к его основанию.
Соберите и приготовьте к работе калориметр: стеклянный сосуд с охлажденной водой поставьте в центр внешнего фарфорового сосуда, накройте его крышкой, в отверстия которой поместите термометр Бекмана, мешалку и в центральное отверстие, осторожно, не касаясь воды, шприц с навеской соли. Обратите внимание на то, что температура, фиксируемая термометром, понижается (вода в сосуде охлаждена) и останавливается на определенной отметке.
Затем начинается медленное повышение температуры. В течение 5 мин. отмечайте по шкале термометра каждую минуту егопоказания с точностью до одной сотой градуса (самое маленькое деление шкалы). Это первый период опыта, в течение которого все детали калориметра принимают постоянную (одинаковую) температуру. На шестой минуте выдавите навеску соли из шприца и энергично перемешивайте раствор, наблюдая за понижением температуры до остановки ртутного столбика. Это соответствует полному растворению соли. Период растворения – главный период опыта. Отметив минимальную температуру, до которой опустился ртутный столбик (время в главном периоде не фиксируется), продолжайте наблюдать за наступающим повышением температуры в калориметре в течение 5мин., отмечая показания каждую минуту - это третий период опыта. Экспериментальные данные, запишите в таблицу. По данным этой таблицы постройте термохимический график.
| 1 период | главный период | 3 период | ||
| τ, мин. | t, ˚ C | Δ t, ˚ C | τ, мин., | t, ˚ C |
| ... 5 | ...5 |
 Термохимический график.
Термохимический график.
t, ˚ C
 |
τ, мин.
Термохимический график  должен быть построен на миллиметровой бумаге с соблюдением масштаба, отвечающего точности измерения термометром Бекмана, т.е. один градус должен соответствовать 10 см построения.
должен быть построен на миллиметровой бумаге с соблюдением масштаба, отвечающего точности измерения термометром Бекмана, т.е. один градус должен соответствовать 10 см построения.
расчет теплоты раствореня расчитывается по формуле:
Qн. = (gpCp+K) •Δ t, (1)
где gp - масса раствора, равная 505 г;
Cp – удельная теплоемкость раствора, равная 0, 95 кал/г;
K – постоянная (константа) калориметра;
Δ t – изменение температуры при растворении соли (по графику).
Удельная теплоемкость раствора находится из табличных данных и равна в данных условиях 0, 95 кал/г.
Константа калориметра рассчитывается по формуле:
К= 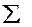 giCi+KT, (2)
giCi+KT, (2)
где: gi – массы деталей калориметра: внутреннего сосуда (см. обозначение на фарфоровом стакане) и мешалки;
Ci – теплоемкости материалов, из которых выполнены детали калориметра.
| Материал | Теплоемкость, С, кал/г |
| Стекло | 0, 19 |
| Алюминий | 0, 22 |
| Сталь | 0, 11 |
| медь | 0, 10 |
Для расчета константы калориметра необходимо знать также величину константы термометра KT. Для этого нужно величину теплоемкости (ртуть и стекло имеют практически одинаковые величины), рассчитанную на один кубический сантиметр и равную 0, 46 кал/см3 умножить на объем погруженной в воду части термометра. Этот объем определяется погружением в мерный цилиндр с водой, налитой до определенной отметки, соответственно до уровня погружения термометра (метка карандашом на термометре). Поднявшийся при этом уровень воды в цилиндре в мл соответствует объему погруженной части термометра в см3.
KT = 0, 46 • Vпогр. (3)
· Рассчитайте по формуле (1) тепловой эффект растворения навески(Qн.)
· найдите интегральную теплоту растворения Δ Н0раст. (для одного моля):
Qн.= - Δ Н0раст. нав.
Δ Н0раст. = Δ Н0раст. нав. ∙ М/g, (4) где
М – молярная масса соли;
g – масса навески.
· Данные представьте в системе СИ, учитывая, что 1 кал = 4, 18 Дж.
· Сделайте вывод по работе.
· Ответьте на вопросы:
1. Сформулируйте первое начало термодинамики.
2. Сформулируйте закон Гесса и следствия из него.
3. Дайте характеристику энтальпии образования.
4. Охарактеризуйте теплоту растворения солей, какими факторами она определяется.
5. На основании представленных данных сделайте вывод, какое из веществ обладает наибольшей способностью к гидратации:
| Соединение | Энергия кристаллической решетки кДж/моль |
| 3CaOSi02 (алит) | |
| 2CaOSi02 (белит) | |
| СаО (негашеная известь) |
6. Работа с грунтами в зимнее время достаточна сложна. Введение в грунт солей предотвращает его смерзание. Несмерзшийся грунт легко уплотняется обычными средствами, кроме того, удачно подобранная соль может значительно ускорять процессы твердения цемента и одновременно несколько пластифицировать бетонную смесь. Выберите из представленных солей наиболее пригодную для использования при температурах: а) ниже – 20 ˚ C, б) до –20˚ C. Выбор обоснуйте.
| соединение | Мольная энтальпия растворения, кДж/моль | Эвтектическая температура раствора, °С |
| Хлорид кальция | - 82, 93 | —55 |
| Хлорид натрия | 3, 89 | —21, 2 |
| Хлорид калия | 17, 23 | —10 |
7. Сформулируйте второе начало термодинамики.
8. Процесс протекает по уравнению:
СаСО3 (кр) + SiO2(кр) → Са SiO3(кр) + CO2(г)
Рассчитайте температуру, при которой наступит состояние равновесия данной системы.
9. Определите возможность протекания реакции:
СаСО3 (кр) → СаО + СО2 (г)
При 1000 К.
Тема. Поверхностные явления. Адсорбция.
Содержание темы. Свободная поверхностная энергия, поверхностное натяжение; изотерма поверхностного натяжения; адсорбция, правило Дюкло-Траубе,; устойчивость дисперсных систем; тиксотропные процессы.
Наиболее важные термины: свободная поверхностная энергия, поверхностное натяжение, ПАВ, ПИВ, ПНВ, сорбция, адсорбция, хемосорбция, адсорбент, адсорбат, поверхностная активность, смчивание, адгезия, когезия, коагуляционные структуры, седиментационная устойчивость, агрегативная устойчивость, тиксотропия, синерезис.